



 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
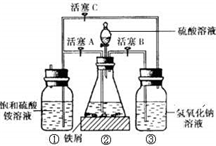 摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用如图所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用如图所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:河北省秦皇岛一中2008-2009学年高二下学期第三次月考化学试题 题型:058
火柴头上通常含有氯酸钾、二氧化锰、硫等物质.某研究性学习小组进行火柴头中有关物质的实验探究.
(1).检验火柴头中含有硫
将两根火柴放在如图所示实验装置中漏斗下面,用一根燃着的火柴点燃它,慢慢拉动注射器活塞抽气,让火柴燃烧产生的气体通过稀品红溶液,观察到品红溶液褪色.
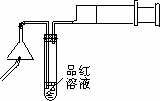
①燃烧产生的气体中一定含有________;
②可用于替代试管中品红溶液的试剂有________(填标号)
A.稀高锰酸钾酸性溶液
B.饱和食盐水
C.稀溴水
D.烧碱溶液
③某同学提出用下图所示方法进行实验更为简便.他的操作是:
ⅰ.当图中所示多支火柴头燃烧完时,立即移出火柴;
ⅱ.__________________________.
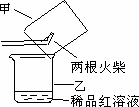
(2).测定火柴头中KClO3的含量主要实验步骤如下:
ⅰ刮取火柴头,小心研碎,称得质量为2.45 g;
ⅱ用适量蒸馏水充分浸泡后过滤、洗涤残渣;
ⅲ往装有滤液和洗涤液的烧杯中加入过量的NaNO2溶液、AgNO3溶液和稀硝酸,搅拌,充分反应后,过滤、洗涤沉淀;
ⅳ干燥沉淀物,称得其质量为1.435 g.
①实验中发生的反应是KClO3+3NaNO2+AgNO3=AgCl↓+3NaNO3+KNO3,其中NaNO2是________剂,反应中AgNO3、NaNO2均需要过量的原因是________;
②实验测得火柴头中KClO3的质量分数为________;
③如果第ⅱ步中未洗涤沉淀残渣,测得KClO3的质量分数将________(填“偏大”、“偏小”、或“无影响”,下同);如果第ⅲ步中未洗涤AgCl沉淀,测得KClO3的质量分数将________.
查看答案和解析>>
科目:高中化学 来源:2011届河南省焦作一中高三12月月考化学试卷 题型:实验题
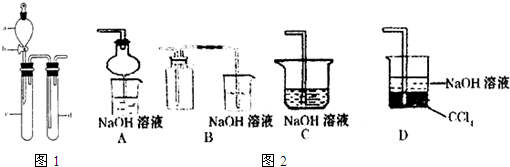
(11分)某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,并制取少量三氧化硫晶体,设计了如图所示的装置。已知三氧化硫遇水生成硫酸并放出大量热,容易形成酸雾,工业上常用浓硫酸吸收三氧化硫。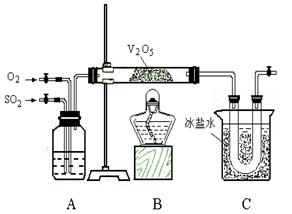
试回答:
(1)已知6.4 g 二氧化硫被氧气氧化成气态三氧化硫,放出9.83 kJ热量。反应的热化学方程式为____________________________________________________;[来源:学+科+网]
(2)A装置可用来观察二氧化硫和氧气的进气量。实验时使A中氧气导管冒出的气泡与二氧化硫导管冒出的气泡速率相近,其目的是___________________________;
(3)检查完装置的气密性且加入药品后,开始进行实验。此时首先应该进行的操作是________________________________。
(4)C装置用来收集三氧化硫,若用a g铜跟足量浓硫酸反应制二氧化硫,实验结 束时得到b g 三氧化硫,该实验中二氧化硫的转化率不小于_________________;
束时得到b g 三氧化硫,该实验中二氧化硫的转化率不小于_________________;
(5)为了减轻实验对环境的污染,请你设计尾气处理装置,绘出装置图:
__________________________________________________________ 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com