
【题目】运用元素周期律,判断下列语句,其中正确的组合是( )
①碱金属单质的熔点随原子序数的增大而降低
②砹(![]() )是第Ⅶ
)是第Ⅶ![]() 族,其氢化物的稳定性小于
族,其氢化物的稳定性小于![]()
③根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤铊(![]() )与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
⑥若X+和Y2﹣的核外电子层结构相同,则原子序数:X>Y
A.①③④B.①②⑥C.③④⑤D.②④⑥
【答案】B
【解析】
①由于从上到下元素的原子半径逐渐增大,所以金属单质Li、Na、K的熔点随原子序数的增大而降低,①正确;
②砹(At)是第VIIA族,非金属性Cl>At,其氢化物的稳定性小于HCl,②正确;
③Mg原子最外层电子处于其轨道的全充满状态,因此Mg的第一电离能比Al大,③错误;
④第二周期非金属元素的气态氢化物溶于水后,氨气的水溶液显碱性,甲烷不溶于水,HF的水溶液为酸性,④错误;
⑤铊(TI)与铝同主族,Tl的金属性大于Al,其单质只能与盐酸反应,⑤错误;
⑥若X+和Y2﹣的核外电子层结构相同,X+是原子失去最外层1个电子形成的,Y2-是原子获得2个电子形成的,所以原子序数:X>Y,⑥正确;
可见正确的说法是①②⑥,故合理选项是B。


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】分子的性质是由分子的结构决定的,通过对下列分子结构的观察来推测它的性质:
![]()
(1)苯基部分可发生____反应和____反应。
(2)—CH![]() CH2部分可发生____反应和___反应。
CH2部分可发生____反应和___反应。
(3)写出此有机物形成的高分子化合物的结构简式:_______。
(4)试判断此有机物的—C(CH2Cl)3部分_______(填“能”或“不能”)发生消去反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定体积的密闭容器中,进行下列反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH=akJ·mol-1
CO(g)+H2O(g) ΔH=akJ·mol-1
其化学平衡常数K和温度T的关系如下表所示:
T(℃) | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
则下列有关叙述正确的是
A.a<0
B.可测量容器总压强变化来判定化学反应是否达到平衡
C.温度为830℃时,若c(CO2)·c(H2)>c(CO)·c(H2O),此时v正>v逆
D.温度不变,增大c(CO2),平衡右移,K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中不是氧化还原反应的是
A. 3Cl2+6KOH===5KCl+KClO3+3H2O
B. CuO+H2![]() Cu+H2O
Cu+H2O
C. 2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D. 2AgNO3+BaCl2===2AgCl↓+Ba(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中K+、Fe2+、SCN-、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3++2I-===Fe2++I2
C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-==Fe(OH)3↓+BaSO4↓
D.1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,制备高纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl![]() SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1000~1100℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题。
(1)第①步制备粗硅的化学反应方程式为___。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点31.8℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为__。
(3)用SiHCl3与过量H2反应制备纯硅的装置如图(热源及夹持装置已略去)。
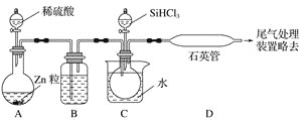
①装置B中的试剂是__,装置C中的烧瓶需要加热,其目的是__;
②反应一段时间后,装置D中观察到的现象是__,装置D不能采用普通玻璃管的原因是__,装置D中发生反应的化学方程式为__;
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及___;
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是___(填字母)。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用黑钡灰(主要成分为BaS)与软锰矿(主要成分为MnO2)为原料制取Ba(OH)2·8H2O和MnCO3的工艺流程如下:
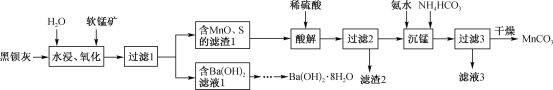
回答下列问题:
(l)“水浸、氧化”时,BaS先转化为Ba(OH)HS溶液,MnO2再氧化Ba(OH)HS。写出第二步反应的化学方程式:_________________________。
(2)过滤1所得“Ba(OH)2滤液”制得Ba(OH)2·8H2O,还需经过的具体实验操作有_________,经干燥得到Ba(OH)2·8H2O产品[已知Ba(OH)2在20℃、60℃、80℃时溶解度依次为:3.76g、17.65g、101.4g]。
(3)“滤渣2”的主要成分为_______(填化学式);“沉锰”时发生反应的离子方程式为________;“滤液3”中可回收的产品为__________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系__(填“属于”或“不属于”)胶体。
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:

根据表中数据判断待测试样为__(填“酸”或“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=__mol·L-1。
(3)煤燃烧排放的烟气含有SO2和NOx,形成酸雨,污染大气,采用NaClO2溶液在碱性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式。
__ClO2-+__NO+__=__Cl-+__NO3-+__
(4)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。写出焦炭与水蒸气反应的化学方程式:__。
②洗涤含SO2的烟气。以下物质可做洗涤剂的是__(填字母)。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(5)汽车尾气中NOx和CO的生成及转化。
①汽车启动后,汽缸温度越高,单位时间内NO排放量越大,写出汽缸中生成NO的化学方程式:__。
②汽车燃油不完全燃烧时产生CO,目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,22.4LH2O含有的分子数为NA
B.Na2O2与CO2反应生成0.1molO2时转移电子0.2NA
C.常温常压下,7.8gNa2O2固体中含有的阴离子数为0.2NA
D.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com