
【题目】燃料电池将是21世纪获得电能的重要途径。近几年开发的丁烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:

请回答下列问题:
(1)Pt(b)电极是电池的________极,电极反应式为_____________________________;Pt(a)电极发生________反应(填“氧化”或“还原”),电极反应式为____________。
(2)若电解质溶液改为KOH溶液,Pt(b)电极的电极反应式为_____________;Pt(a)电极的电极反应式为_____________________________________________________________。
(3)如果该电池工作时电路中通过1.2 mol电子,则消耗掉O2在标准状况下的体积为________L。
【答案】
(1) 正,O2+4e-+4H+═2H2O;氧化,CH4-8e-+2H2O═CO2+8H+;
(2) O2+2H2O+4e-==4OH-,C4H10+34OH--26e-====4CO32-+22H2O ;
(3) 6.72L
【解析】
试题分析:(1)燃料电池中通氧气的一极发生还原反应为电池的正极,图上可以看出是酸性燃料电池,电极反应是为O2+4e-+4H+═2H2O,加燃料的一极发生氧化反应,为电池的负极,电极反应式为:CH4-8e-+2H2O═CO2+8H+,答案为:正,O2+4e-+4H+═2H2O;氧化,CH4-8e-+2H2O═CO2+8H+;(2)电解质溶液改为KOH溶液,Pt(b)电极的电极反应式为O2+2H2O+4e-==4OH-,Pt(a)电极的电极反应式为:C4H10+34OH--26e-====4CO32-+22H2O,答案为:O2+2H2O+4e-==4OH-,C4H10+34OH--26e-====4CO32-+22H2O ;(3)每反应掉1mol氧气,转移4mol电子,所以转移1.2mol电子,反应了的氧气的物质的量为:0.3mol,标准状况下的体积为6.72L,答案为:6.72L.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】(一)已知断裂1mol C—H键,要吸收热量414.4 kJ;断裂1 mol C—C键,要吸收热量347.4 kJ;生成1 mol C===C键,会放出热量615.3 kJ;生成1 mol H—H键,会放出热量435.3 kJ。某有机物分解的反应可表示为:

若在反应中消耗了1 mol乙烷,则有关该反应的说法正确的是
A.该反应放出251.2 kJ的热量
B.该反应吸收251.2 kJ的热量
C.该反应放出125.6 kJ的热量
D.该反应吸收125.6 kJ的热量
(二)如图所示的原电池,一段时间后某极析出1.28g的固体。回答下列问题:

(1)正极是 (填“锌”或“银”),发生了 反应。
(2)正极的电极反应为 。
(3)上述过程中共转移电子 mol。
(4)锌片的质量 (填“增加”或“减少”) g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿斯巴甜(APM)是一种较适合糖尿病患者食用的蔗糖代替品,其一种合成路线如图,其中A、B、C、D、E均为有机物,部分反应条件和产物已略去.
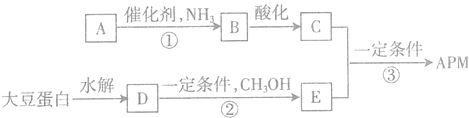
已知:①由C、H、O三种元素组成的二元羧A,相对分子质量为116,其羧连接在不同碳原子上,且核磁共振氢谱有两个面积相等的吸收峰.
②C、D所含官能团相同;D为单取代芳香化合物,是大豆蛋白水解的最终产物之一,其分子式为C9H11NO2,且分子中不含甲基.
回答下列问题:
(1)A的分子式为___________,结构简式为___________。
(2)反应①的化学方程式为___________ ,C中所含官能团的名称为___________。
(3)D通过醋化反应生成E,反应的化学方程式为___________。
(4)APM是一种二肽,上述过程中APM可能的结构简式为___________和___________。
(5)D物质的同分异构体有多种,能同时满足下列条件的共有___________种(不含立体异构).
①苯环上有两个取代基 ②分子中含有硝基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O。请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加____g。
2PbSO4+2H2O。请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加____g。
(2)微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-。
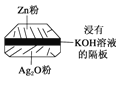
根据上述反应式,完成下列题目。
(1)下列叙述正确的是________。
A.在使用过程中,电解质KOH被不断消耗
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
(2)写出电池的总反应式:___________________________________________________________。
(3)使用时,负极区的pH________(填“增大”“减小”或“不变”,下同),正极区的pH______,电解质溶液的pH________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。请回答:
(1)基态铜原子的电子排布式为 ;已知高温下CuO→Cu2O+O2,从铜原子价层电子结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是 。
(2)硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为 ,若“Si—H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se Si(填“>”、“<”)。
(3)SeO2常温下白色晶体,熔点为340~350℃,315℃时升华,则SeO2固体的晶体类型为 ;若SeO2类似于SO2是V型分子,则Se原子外层轨道的杂化类型为 。
(4)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3·NH3。BF3·NH3中B原子的杂化轨道类型为 ,B与N之间形成 键。
(5)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为 ,在SiC中,每个C原子周围最近的C原子数目为 个;若晶胞的边长为a pm,则金刚砂的密度表达式为 g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在容积固定的某密闭容器中发生反应N2+3H2![]() 2NH3。在10s内N2的浓度由5 mol·L-1降至4 mol·L-1,下列说法正确的是( )
2NH3。在10s内N2的浓度由5 mol·L-1降至4 mol·L-1,下列说法正确的是( )
A. 用NH3表示的化学反应速率为0.1 mol·L-1·s-1
B. 使用合适的催化剂,可以加快该反应的速率
C. 增加H2的浓度或降低温度都会加快该反应速率
D. 反应足够长时间,N2、H2中至少有一种物质浓度降为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中( )
A.至少存在5种离子 B.SO42-、NH4+一定存在,Cl-可能不存在
C.Cl-一定存在,且c(Cl-)≥0.4 mol/L D.CO32-、Al3+一定不存在,K+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
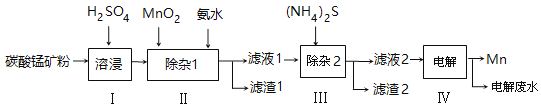
已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是: 。
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为 (填化学式)。已知MnO2的作用为氧化剂,则得到该滤渣1所涉及的离子方程式为 、 。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是 。
(4)滤液2中,c(Co2+):c(Ni2+)= 。
(5)将质量为akg的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为 。(用含a、b、c的式子表达,无需化简)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N和Si是合成新型非金属材料的两种重要元素。请回答:
(1)基态Si原子的价层电子排布图为 ;Si原子可形成多种氢化物,其中Si2H6中Si原子的价层电子对数目为 。
(2)ClO3-、ClO4-中Cl都是以 轨道与O原子 轨道成键,其微粒的立体结构分别为 、 。
(3)N和Si形成的原子晶体中,N原子的配位数为 。
(4)NaN3常作为汽车安全气囊的填充物,其焰色反应为黄色。大多数金属元素有焰色反应的微观原因为 ;N3-中σ键和π键的数目之比为 。B、F与N三种元素同周期,三种基态原子的第一电离能由大到小的顺序为 (用元素符号表示)
(5)SiO2的晶胞与金刚石(如图所示)相似,可以看作Si原子替代C原子后,在两个成键的Si原子间插入1个O原子形成。则:
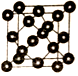
①晶胞中最小的环含有_____个原子。
②若晶体密度为ρg·cm3,阿伏伽德罗常数为NA,晶胞中两个最近的Si原子核之间的距离为____pm(用代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com