
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示( 图中的△H表示生成1mol产物的数据)。根据图示,回答下列问题:

⑴P和Cl2反应生成PCl3(g)的热化学方程式 。
⑵PCl5(g)分解成PCl3(g)和Cl2的热化学方程式 。
⑶白磷能自燃,红磷不能自燃。白磷转变成红磷为 (“放”或“吸”) 热反应。如果用白磷替代红磷和Cl2反应生成1molPCl5的△H3,则△H3 △H1 (填“<”、“>” 或 “=”) 。
(1)P(s)+ Cl2(g)=PCl3(g)△H=-306 kJ/mol
Cl2(g)=PCl3(g)△H=-306 kJ/mol
(2)PCl5(g)=PCl3(g)+Cl2(g)△H=+93 kJ/mol (3)放;<
【解析】
试题分析:(1)根据图示可知:P(s)+ Cl2(g)=PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H=-306 kJ/mol,则热化学方程式为:P(s)+
Cl2(g)=PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H=-306 kJ/mol,则热化学方程式为:P(s)+ Cl2(g)=PCl3(g)△H=-306 kJ/mol。
Cl2(g)=PCl3(g)△H=-306 kJ/mol。
(2)根据图示可知:Cl2(g)+PCl3(g)=PCl5(g),中间产物的总能量大于最终产物的总能量,该反应是放热反应,△H=生成物总能量-反应物总能量=-93 kJ/mol;所以PCl5(g)=PCl3(g)+Cl2(g)是吸热反应;热化学方程式:PCl5(g)=PCl3(g)+Cl2(g)△H=+93 kJ/mol。
(3)白磷能自燃,红磷不能自燃,这说明白磷的总能量高于红磷的总能量,因此白磷转变成红磷为放热反应。由于白磷总能量高于红磷总能量,所以如果用白磷替代红磷和Cl2反应生成1molPCl5时放出的热量多,则反应热△H3<△H1 。
考点:考查热化学方程式的书写、反应热的计算以及反应热的应用等


 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源:2015届江西五校高三第一次联考化学试卷(解析版) 题型:选择题
将足量的CO2不断通入NaOH、Ba(OH)2、NaAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )

查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市协作体高二下学期期中考试化学试卷(解析版) 题型:选择题
某学生实验小组用50 mL 0.50 mol·L-1的盐酸与50 mL 0.50 mol·L-1的NaOH溶液在右图所示的装置中进行中和反应反应热的测定。

(1)图中装置缺少一种仪器,该仪器名称为______。
(2)下列说法正确的是______。
A.小烧杯内残留有水,会使测得的反应热数值偏小
B.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅
C.烧杯间填满碎纸条的作用是固定小烧杯
D.可用相同浓度和体积的硝酸代替稀盐酸溶液进行实验
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市协作体高二下学期期中考试化学试卷(解析版) 题型:选择题
在2A + B = 3C + 4D的反应中,下列表示该反应速率最大的是
A.V(C) =0.5mol / (L·min) B.V(A)=0.8mol / (L·min)
C.V(B)=0.3mol / (L·min) D.V(D)= 1mol / (L·min)
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市协作体高二下学期期中考试化学试卷(解析版) 题型:选择题
对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
A、加入一种反应物 B、升高温度
C、对平衡体系增加压强 D、使用催化剂
查看答案和解析>>
科目:高中化学 来源:2015届江苏省沭阳县高二下学期期中调研测试化学试卷(解析版) 题型:选择题
在一个体积可变的密闭容器中,通入2molHI气体,在一定条件下建立如下平衡:2HI(g) I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是
I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是
A.保持容器体积不变,升高温度,混合气体的颜色逐渐变深
B.恒温,恒容,充入一定量氦气(不参与反应),则正反应速率和逆反应速率均增大
C.恒温,缓慢压缩容器,使容器体积恒定为0.2L,一定时间后,测得c(I2)=2.5mol/L
D.恒温、恒压,再通入2molHI气体,到达平衡状态后,HI转化率会提高
查看答案和解析>>
科目:高中化学 来源:2015届江苏省沭阳县高二下学期期中调研测试化学试卷(解析版) 题型:选择题
氯化钴溶液中存在下列平衡:CoCl42-(蓝色) Co2+(粉红色)+4Cl-,向氯化钴稀溶液中加入一定量的浓盐酸,溶液的颜色变化是
Co2+(粉红色)+4Cl-,向氯化钴稀溶液中加入一定量的浓盐酸,溶液的颜色变化是
A.由蓝色变为粉红色 B.红色加深
C.由粉红色变为蓝色 D.蓝色加深
查看答案和解析>>
科目:高中化学 来源:2015届江苏省无锡江阴市高二下学期期中考试化学试卷(解析版) 题型:选择题
有A、B、C、D四种金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线连接后浸入稀H2SO4中,电流由D导线C;③A、C相连后同时浸入稀H2SO4中,C极产生大量气泡;④B、D相连后同时浸入稀H2SO4中,D极发生氧化反应,试判断四种金属的活动顺序是
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
常温下,下列溶液中,有关微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液: c(NH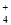 )> c(SO
)> c(SO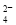 )>c(Fe2+)>c(H+)
)>c(Fe2+)>c(H+)
B.0.1 mol·L-1 Na2CO3溶液:c(Na+)+c(H+)=c(CO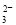 )+c(HCO
)+c(HCO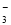 )+c(OH-)
)+c(OH-)
C.0.1 mol·L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO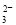 )
)
D.0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液中:
c (CH3COO-) > c (Na+) > c (H+)> c (OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com