
| A、锌 镁 |
| B、铁 铝 |
| C、铁 锌 |
| D、镁 铁 |
. |
| M |
| m总 |
| n总 |
| 11.2L |
| 22.4L/mol |
| 10 |
| 0.5 |
| 2 |
| 3 |


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
| A、0.1mol/L100mL稀硫酸中含有硫酸根个数为0.1NA |
| B、1molCH3+(碳正离子)中含有电子数为10 NA |
| C、金属镁与足量的盐酸反应,转移电子数为2 NA时,生成氢气为22.4L |
| D、12.4g白磷中含有磷原子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、91.6% |
| B、83.2% |
| C、75.0% |
| D、67.6% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2 | B、2:3 |
| C、3:2 | D、1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
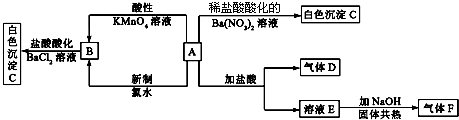
查看答案和解析>>
科目:高中化学 来源: 题型:
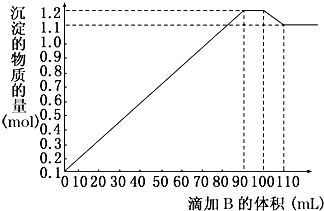
| 溶质 | Na2SO4 | BaCl2 | AlCl3 | FeCl3 |
| c/mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 气体物质 | 主要来源 | 对环境的影响 | |
| A | 二氧化碳 | 化石燃料的燃烧 | 酸雨 |
| B | 二氧化硫 | 汽车尾气的排放 | 光化学烟雾 |
| C | 二氧化氮 | 工厂废气的排放 | 温室效应 |
| D | 甲醛 | 各类含酚醛树脂胶的人造板装饰材料 | 室内空气污染 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com