
| A£®¦¤H1>¦¤H2>¦¤H3 |
| B£®¦¤H2>¦¤H3>¦¤H1 |
| C£®¦¤H1£½¦¤H2£½¦¤H3 |
| D£®¦¤H1>¦¤H3>¦¤H2 |
 ŹĄ¼Ķ°ŁĶØÖ÷ĢåæĪĢĆŠ”ѧæĪŹ±Ķ¬²½“ļ±źĻµĮŠ“š°ø
ŹĄ¼Ķ°ŁĶØÖ÷ĢåæĪĢĆŠ”ѧæĪŹ±Ķ¬²½“ļ±źĻµĮŠ“š°ø ŹĄ¼Ķ°ŁĶØÓÅĮ·²āĻµĮŠ“š°ø
ŹĄ¼Ķ°ŁĶØÓÅĮ·²āĻµĮŠ“š°ø °Ł·Öѧɜ×÷Ņµ±¾ĢāĮ·ĶõĻµĮŠ“š°ø
°Ł·Öѧɜ×÷Ņµ±¾ĢāĮ·ĶõĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
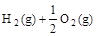 £½H2O£Øg£© ¦¤H1£½a kJ”¤
£½H2O£Øg£© ¦¤H1£½a kJ”¤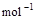
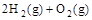 £½2H2O£Øg£© ¦¤H2£½b kJ”¤
£½2H2O£Øg£© ¦¤H2£½b kJ”¤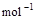
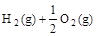 £½H2O£Øl£© ¦¤H3£½c kJ”¤
£½H2O£Øl£© ¦¤H3£½c kJ”¤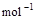
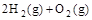 £½2H2O£Øl£© ¦¤H4£½d kJ”¤
£½2H2O£Øl£© ¦¤H4£½d kJ”¤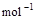
| A£® a£¼c £¼0 | B£®b£¾d£¾0 | C£®2a£½b£¼0 | D£®2c£½d£¾0 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
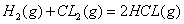 )ŌŚ¹āÕÕŗĶµćČ¼Ģõ¼žµÄ”÷HĻąĶ¬
)ŌŚ¹āÕÕŗĶµćČ¼Ģõ¼žµÄ”÷HĻąĶ¬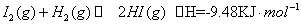
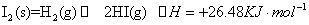
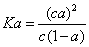 ”£Čō¼ÓČėÉŁĮæ“×ĖįÄĘ¹ĢĢ壬ŌņCH3COOH£»”ŖŅ»CH3COO -Ź®H+Ļņ×óŅĘ¶Æ£¬a¼õŠ”£¬Ka±äŠ”Čō¼ÓČėÉŁĮæ“×ĖįÄĘ¹ĢĢ壬Ōņ
”£Čō¼ÓČėÉŁĮæ“×ĖįÄĘ¹ĢĢ壬ŌņCH3COOH£»”ŖŅ»CH3COO -Ź®H+Ļņ×óŅĘ¶Æ£¬a¼õŠ”£¬Ka±äŠ”Čō¼ÓČėÉŁĮæ“×ĖįÄĘ¹ĢĢ壬Ōņ
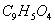 Ź®H+Ļņ×óŅĘ¶Æ£¬a¼õŠ”£¬Ka±äŠ”
Ź®H+Ļņ×óŅĘ¶Æ£¬a¼õŠ”£¬Ka±äŠ”²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā


²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ĖįÓė¼īµÄÖŠŗĶ·“Ó¦ | B£®Ź³ĪļŅņŃõ»Æ¶ųøÆ°Ü |
| C£®ģŃÉÕŹÆ»ŅŹÆ”””” | D£®ÕØŅ©±¬ÕØ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
A£®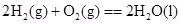 ”””””” ””””””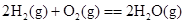 |
B£® ”””” ””””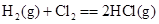 |
C£® ”””””””” ””””””””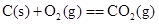 |
D£®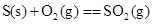 ”””””””””” ””””””””””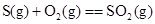 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| »ÆѧĪļÖŹ | H2(g) | Br2(g) | HBr(g) |
| 1mol·Ö×ÓÖŠµÄ»Æѧ¼ü¶ĻĮŃŹ±ŠčŅŖĪüŹÕµÄÄÜĮæ/KJ | 436 | a | 369 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
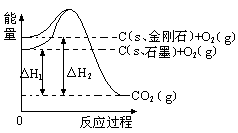
| A£®½šøÕŹÆ±ČŹÆÄ«ĪČ¶ØŠŌĒæ |
| B£®ŹÆÄ«±äĪŖ½šøÕŹÆŹĒĪļĄķ±ä»Æ |
| C£®ŹÆÄ«±äĪŖ½šøÕŹÆŹĒ·ÅČČ·“Ó¦ |
| D£®1 molŹÆÄ«µÄ×ܼüÄܱČ1 mol½šøÕŹÆµÄ×ܼüÄÜ“ó1.9 kJ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
A£®H2O(g) = H2(g)+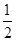 O2(g)”÷H£½ +242kJ·mol-1 O2(g)”÷H£½ +242kJ·mol-1 |
| B£®2H2(g)+O2(g)= 2H2O(l) ”÷H£½ £484kJ·mol-1 |
C£®H2(g)+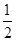 O2(g)=H2O(g) ”÷H£½ +242kJ·mol-1 O2(g)=H2O(g) ”÷H£½ +242kJ·mol-1 |
| D£®2H2(g)+O2(g)=2H2O(g) ”÷H£½ +484kJ·mol-1 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com