
【题目】A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
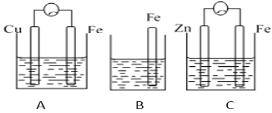
(1) B中反应的离子方程式为______。
(2) A中作正极的金属是_____,该电极上看到的现象为_____。
(3) C中作负极的金属是____,该电极反应方程式为______。
(4)现有未知金属A,将A与Fe用导线相连后放入稀硫酸溶液中,观察到A上有气泡,在A上发生____反应。(填“氧化”或“还原”)。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氮化锶(Sr3N2)在工业上广泛用于生产荧光粉。锶与氮气在加热条件下可生成氮化锶,氮化锶遇水剧烈反应。某同学设计如下装置制备氮化锶(各装置盛装足量试剂),所使用的氮气样品可能含有少量CO、CO2、O2等气体杂质。
已知:醋酸二氨合亚铜CH3COO[Cu(NH3)2]溶液能定量吸收CO,但易被O2氧化,失去吸收CO能力;连苯三酚碱性溶液能定量吸收O2。
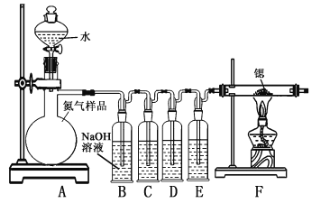
Ⅰ.氮化锶的制取
(1)装置B仪器的名称是_____________。
(2)装置C、D、E盛装的试剂分别是_____________(填代号)。
甲.连苯三酚碱性溶液 乙.浓硫酸 丙.醋酸二氨合亚铜溶液
(3)该套装置设计存在缺陷,可能会导致产品变质,提出改进方案____________。
Ⅱ.产品纯度的测定
称取6.0 g Ⅰ中所得产品,加入干燥的三颈瓶中,然后由恒压漏斗加入蒸馏水,通入水蒸气,将产生的氨全部蒸出,用200mL1.00mol/L的盐酸标准溶液完全吸收(吸收液体积变化忽略不计)。从烧杯中量取20.00 mL的吸收液,用1.00mol/LNaOH标准溶液滴定过剩的HCl,到终点时消耗16.00mLNaOH溶液。(图中夹持装置略)
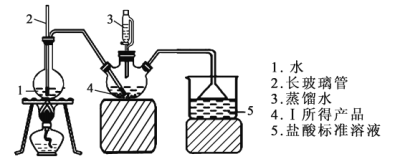
(4)三颈瓶中发生的化学反应方程式为____________________________。
(5)装置中2的作用为__________________________________________。
(6)用1.00mol/LNaOH标准溶液滴定过剩的HCl时所选指示剂为_________(填字母)。
a.石蕊试液 b.酚酞试液 c.甲基橙
(7)产品纯度为____________________。
(8)下列实验操作可能使氮化锶(Sr3N2)测定结果偏高的是_________(填字母)。
a.滴定时未用NaOH标准溶液润洗滴定管
b.读数时,滴定前平视,滴定后俯视
c.摇动锥形瓶时有液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种元素:其中A、B、C、D、E是短周期元素,F为过渡金属,原子序数依次增大,A、B处于同一周期,B的最外层电子数是内层电子数的3倍。C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种化合物甲和乙。D、A按原子个数比3∶2形成离子化合物丙。E是地壳中含量最高的金属元素,F是生活生产中用量最多的金属。根据以上信息回答下列问题:
(1)A原子最外层的电子排布图_______
(2)B元素在周期表中的位置是______________
(3)化合物乙的化学键类型是________________
(4)化合物丙的电子式是____________
(5)F的电子排布式是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道一些明胶企业将皮革废料熬制成工业明胶,出售给某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬,从而对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是________价。CrO2-是一种酸根离子,则Fe(CrO2)2属于________(填“酸”“碱”“盐”或“氧化物”)。
(2)明胶的水溶液和K2SO4溶液共同具备的性质是________(填序号)。
a.都不稳定,密封放置产生沉淀
b.两者均有丁达尔效应
c.分散质微粒可通过滤纸
(3)已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯明胶的装置是下列中的________(填序号)。
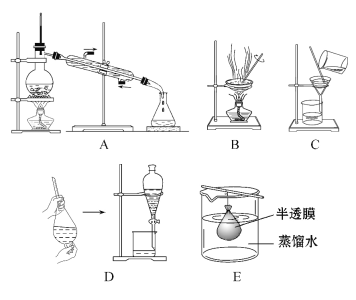
(4)现有10 mL明胶的水溶液与5 mL Na2SO4溶液混合装入半透膜内,将此半透膜浸入盛蒸馏水的烧杯中,设计实验证明SO42-能够透过半透膜:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用下图装置探究草酸亚铁晶体(FeC2O4·2H2O)的分解产物,下列说法错误的是
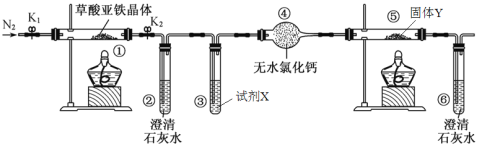
A. 实验前通入N2的作用是排出装置内的空气
B. ②、⑥中澄清石灰水的作用均是为了检验CO2气体
C. 装置中试剂X为NaOH溶液,固体Y为CuO固体
D. 将①中所得固体溶于KSCN溶液,可以检验其中铁元素的化合价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的有
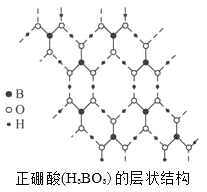
A. 在H3BO3分子中各原子最外层全部满足8电子稳定结构
B. H3BO3分子的稳定性与氢键有关
C. 1mol H3BO3的晶体中有3mol极性共价键
D. 1mol H3BO3的晶体中有3mol氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2可用作食品添加剂。NaNO2能发生以下反应:3NO2-+2H+=NO3-+2NO↑+H2O
NO2-+Ag+=AgNO2↓(淡黄色)
某化学兴趣小组进行以下探究。回答有关问题:
(l)制取NaNO2反应原理:Na2CO3+2NO2=NaNO2+NaNO3+CO2 Na2CO3+NO+NO2=2NaNO2+CO2
用下图所示装置进行实验。
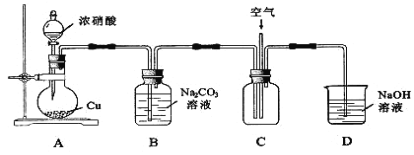
①铜与浓硝酸反应的化学方程式为______________________________。
②实验过程中,需控制B中溶液的pH>7,否则产率会下降,理由是_________。
③往C中通入空气的目的是____________________(用化学方程式表示)。
④反应结束后,B中溶液经蒸发浓缩、冷却结品、___________ 等操作,可得到粗产品晶体和母液。
(2)测定粗产品中NaNO2的含量
称取5.000g粗产品,溶解后稀释至250mL。取出25.00 mL溶液,用0.1000 mol·L-1KMNO4酸性溶液平行滴定三次,平均消耗的体积为20.00mL。已知:2MnO4-+6H++5NO2-=5NO3-+2Mn2++3H2O
①稀释溶液时,需使用的玻璃仪器除烧杯、玻璃棒外,还有 _________(填标号)。
A.容量瓶 B.量筒 C.胶头滴管 D.锥形瓶
②当观察到_________________时,滴定达到终点。
③粗产品中NaNO2的质量分数为____________ (用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1molCl-、ClO![]() (x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是( )
(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是( )
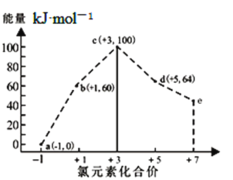
A.a、b、c、d、e中,c最稳定
B.b→a+c反应的活化能为60kJ·mol-1
C.b→a+d反应的热化学方程式为3ClO-(aq)=ClO![]() (aq)+2Cl-(aq)△H=-116kJ·mol-1
(aq)+2Cl-(aq)△H=-116kJ·mol-1
D.e是ClO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com