

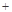 O2
O2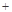 2H2SO4=2CuSO4
2H2SO4=2CuSO4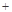 2H2O)
2H2O)| A.相对于途径①、③,途径②更好地体现了绿色化学思想 |
| B.途径③中,1mol Cu与足量浓硫酸反应会产生64g SO2气体 |
C.途径①所用混酸中H2SO4与HNO3物质的量之比最好为 |
D.1mol Cu分别按照途径②、③中,被还原的H2SO4的质量之比为 |
 CuSO4+SO2↑+2H2O,1mol Cu与足量浓硫酸反应会产生64gSO2气体,正确;C、Cu与混酸反应,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,离子反应为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,从方程式知,硝酸根离子由硝酸提供,氢离子由硝酸和硫酸提供,所以硝酸为2mol时,硫酸为3mol,用混酸中H2SO4与HNO3物质的量之比最好为3:2,正确;D、途径② 反应为:2Cu+2H2SO4+O2=2CuSO4+2H2O,H2SO4不被还原,错误。
CuSO4+SO2↑+2H2O,1mol Cu与足量浓硫酸反应会产生64gSO2气体,正确;C、Cu与混酸反应,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,离子反应为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,从方程式知,硝酸根离子由硝酸提供,氢离子由硝酸和硫酸提供,所以硝酸为2mol时,硫酸为3mol,用混酸中H2SO4与HNO3物质的量之比最好为3:2,正确;D、途径② 反应为:2Cu+2H2SO4+O2=2CuSO4+2H2O,H2SO4不被还原,错误。

科目:高中化学 来源:不详 题型:填空题
| A.Ba(NO3)2 | B.BaCl2 | C.Ba(OH)2 | D.溶有NH3的BaCl2溶液 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1∶1 | B.1∶2 | C.2∶3 | D.4∶3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①⑤ | B.②③④ | C.全部 | D.都不是 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.S的漂白性 | B.S的还原性 |
| C.SO2的漂白性 | D.SO2的还原性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1个 | B.2个 | C.3个 | D.5个 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
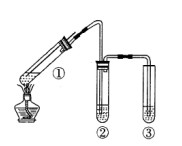
| A.上下移动①中铜丝可控制SO2的量 |
| B.②中选用品红溶液验证SO2的生成 |
| C.③中选用NaOH溶液吸收多余的SO2 |
| D.为确认CuSO4生成,向①中加水,观察颜色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.高沸点性; | B.酸性; | C.吸水性; | D.脱水性;(E)强氧化性。试用字母填空: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
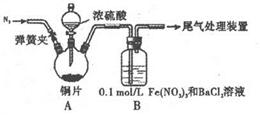
| A.将产生的气体缓缓通过预先称量的盛有碱石灰的干燥管,结束反应后再次称貴 |
| B.将产生的气体缓缓通入酸性髙锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀 |
| C.用排水法测定其产生气体的体积(折算成标准状况) |
| D.用排饱和NaHSO3溶液的方法测定其产生气体的体积(折算成标准状况) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com