
| A. | c(Al3+)=0.1mol/L的溶液中:Na+、K+、HS-、SO42- | |
| B. | 使酚酞呈红色的溶液中:K+、Ba2+、I-、NO3- | |
| C. | 由水电离出的c(H+)=10-13mol/L的溶液中:Na+、HCO3-、Cl-、Br- | |
| D. | 加入Al能放出H2的溶液中:Cl-、SO42-、NO3-、Mg2+ |
分析 A.离子之间相互促进水解;
B.使酚酞呈红色的溶液,显碱性;
C.由水电离出的c(H+)=10-13mol/L的溶液,为酸或碱溶液;
D.加入Al能放出H2的溶液,为非氧化性酸或强碱溶液.
解答 解:A.Al3+、HS-相互促进水解,不能大量共存,故A错误;
B.使酚酞呈红色的溶液,显碱性,该组离子之间不反应,可大量共存,故B正确;
C.由水电离出的c(H+)=10-13mol/L的溶液,为酸或碱溶液,酸、碱溶液中一定不能大量存在HCO3-,故C错误;
D.加入Al能放出H2的溶液,为非氧化性酸或强碱溶液,碱溶液中不能大量存在Mg2+,酸溶液中Al、NO3-发生氧化还原反应不生成氢气,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重水解反应、氧化还原反应、复分解反应的离子共存考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 增大压强,化学反应速率一定加快 | |
| B. | 其它条件不变,温度越高,反应速率越快 | |
| C. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 | |
| D. | 增加反应物的量,反应速率一定加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离溴水中的溴 | 乙醇萃取 | 溴在乙醇中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去乙烷中的乙烯 | 酸性高锰酸钾液体、洗气 | 乙烯可以用碱性高锰酸钾溶液除去氯化钠在水中的溶解度很大 |
| D | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 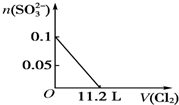 | B. | 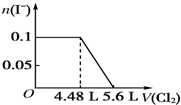 | ||
| C. | 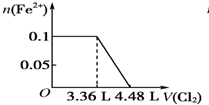 | D. | 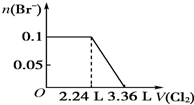 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
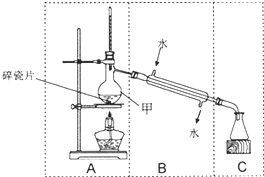 如图装置在中学化学实验中常用于物质的分离与提纯.
如图装置在中学化学实验中常用于物质的分离与提纯.| A.除去CO2气体中混有的少量HCl气体 |
| B.从硝酸钾和氯化钠的混合物中提纯得到硝酸钾 |
| C.用含有Fe3+的自来水获得少量纯净的水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com