
【题目】A为金属单质,B、C、D、E 四种均为含有氯元素的物质,它们存在如图转化关系(部分产物已略去,有的反应在溶液中进行)。请回答:

(1)A 是_____________,C 是_____________。(均用化学式表示)
(2)写出实验室制备 D 的化学方程式:_____________。
(3)写出用 B 溶液与 Cu 反应制作印刷电路板的离子方程式:_____________。
(4)设计实验方案,检验 C 溶液中的金属阳离子:_____________
【答案】Fe FeCl2 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O Cu+2Fe3+═Cu2++2Fe2+ 取C溶液于试管中,向其中滴加KSCN溶液,溶液不变色,再滴加氧化剂(如氯水、双氧水)后溶液显血红色,说明含有Fe2+,或者取样滴加用铁氰化钾溶液,有蓝色沉淀产生,则含有Fe2+
MnCl2+Cl2↑+2H2O Cu+2Fe3+═Cu2++2Fe2+ 取C溶液于试管中,向其中滴加KSCN溶液,溶液不变色,再滴加氧化剂(如氯水、双氧水)后溶液显血红色,说明含有Fe2+,或者取样滴加用铁氰化钾溶液,有蓝色沉淀产生,则含有Fe2+
【解析】
A为金属单质,B、C、D、E四种均为含有氯元素的物质,根据转化关系可知,A为变价金属,且B与A反应生成C,则A为Fe,D为Cl2,B为FeCl3,C为FeCl2,A与E反应生成C(FeCl2),结合(3)“用B溶液与Cu反应制作印刷电路板”可知,E为HCl,据此解答。
(1)根据分析可知,A为Fe,C为FeCl2,
故答案为:Fe;FeCl2;
(2)实验室中通过加热浓盐酸与二氧化锰制取氯气,该反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(3)B为FeCl3,Cu与氯化铁反应生成氯化亚铁和氯化铜,该反应的离子方程式为:Cu+2Fe3+═Cu2++2Fe2+,
故答案为:Cu+2Fe3+═Cu2++2Fe2+;
(4)C为FeCl2,其阳离子为Fe2+,检验Fe2+的方法为:取C溶液于试管中,向其中滴加KSCN溶液,溶液不变色,再滴加氧化剂(如氯水.双氧水)后溶液显血红色,说明含有Fe2+,或者取样滴加用铁氰化钾溶液,有蓝色沉淀产生,则含有Fe2+,
故答案为:取C溶液于试管中,向其中滴加KSCN溶液,溶液不变色,再滴加氧化剂(如氯水.双氧水)后溶液显血红色,说明含有Fe2+,或者取样滴加用铁氰化钾溶液,有蓝色沉淀产生,则含有Fe2+。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】200mL 1molL—1的氯化铝溶液中加入一定体积的2molL—1的NaOH溶液,最终产生7.8g沉淀,则加入的NaOH溶液的体积可能为
①350mL ②90mL ③150mL ④200mL
A. 只有① B. ①③ C. ②④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,它们的原子序数依次增大。①A元素组成的单质是相同条件下密度最小的物质;②B元素原子的最外层电子数是其内层电子总数的2倍;③D原子的电子层数与最外层电子数之比为3:1;④E元素的最外层电子数是电子层数的2倍;⑤C与E同主族。请回答下列问题:
(1)B元素在周期表中的位置是:______________
(2)写出化合物D2C2的电子式____________;该化合物中所含化学键类型为____________
(3)化合物A2C和A2E中,沸点较高的是______________(填化学式)
(4)化合物EC2常温下呈气态,将其通入Ba(NO3)2溶液中,有白色沉淀和NO气体放出,该反应的离子方程式为_______________
(5)元素A、B、C按原子个数比2:1:1组成的化合物是常见的室内装修污染物,该物质的分子空间构型为______________;该化合物中B原子的杂化轨道类型为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常工业上监测SO2含量是否达到排放标准的化学反应原理是SO2+ H2O2+ BaCl2= BaSO4↓+ 2HC1 ,用NA表示阿伏加德罗常数的值,下列说法不正确的是
A. 0.1 molBaCl2中所含离子总数约为0.3 NA
B. 25℃时,pH=l的HC1溶液中含有H+的数目约为0.1 NA
C. 标准状况下,17gH2O2中所含电子总数约为9 NA
D. 生成2.33gBaSO4沉淀时,吸收SO2的体积在标准状况下约为0.224L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,不能通过一步反应实现如图所示转化的是( )
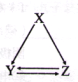
选项 | X | Y | Z |
A | AlCl3 | Al(OH)3 | NaAlO2 |
B | C | CO | CO2 |
C | CH2=CH2 | CH3CH2Br | CH3CH2OH |
D | S | SO2 | SO3 |
A.AB.BC..CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容器中发生一个化学反应,反应过程存在H2O、ClO-、CN-、HCO3-、N2、Cl-6种物质,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是
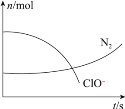
A.当有3molClO-参加反应时,则有1molN2生成
B.HCO3-作为碱性介质参与反应
C.当有5molClO-参加反应时,则有1molN2生成
D.若生成2.24LN2,则转移电子0.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg·cm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。[配制酸性KMnO4标准溶液]如图是配制50mL酸性KMnO4标准溶液的过程示意图。
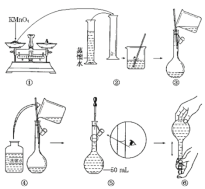
(1)请你观察图示判断其中不正确的操作有________(填序号)。
(2)其中确定50mL溶液体积的容器是__________________________________(填名称)。
(3)如果按照图示的操作所配制的溶液进行实验,在其他操作均正确的情况下,所测得的实验结果将______(填“偏大”或“偏小”)。
[测定血液样品中Ca2+的浓度]抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol·L-1酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL酸性KMnO4溶液。
(4)已知草酸与酸性KMnO4溶液反应的离子方程式为:2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O滴定时,根据现象_______________________________________,即可确定反应达到终点。
(5)经过计算,血液样品中Ca2+的浓度为________mg·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质量为ag的铜片在空气中灼烧变黑,趁热放入下列物质中铜丝变为红色,而且质量仍为ag的是( )
①硝酸②无水乙醇③盐酸④CO⑤H2
A.①②④B.②④⑤C.②⑤D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是( )
A. 组别①中,0~20min内,NO2的降解速率为0.0125mol·L-1·min-1
B. 由实验数据可知该反应较适宜的温度为T1
C. 40min时,表格中T2应填的数据为0.18
D. 0~10min内,CH4的降解速率①>②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com