
如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
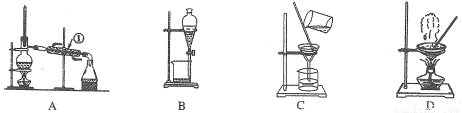
(1)从氯化钾溶液中得 到氯化钾固体,选择装置 (填代表装置图的字母,下同);除去自来水中的C1?等杂质,选择装置 。
到氯化钾固体,选择装置 (填代表装置图的字母,下同);除去自来水中的C1?等杂质,选择装置 。
(2)从碘水中分离出I2,选择装置 ,该分离方法的名 称为 。
称为 。
(3)装置A中①的名称是 ,进水的方向是从 口进水。装置B在分液时为使液体顺利滴下,除打开上口活塞外,还应进行的具体操作是 。
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:

粗盐中含Ca2+、Mg2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④加入略过量的盐酸 ⑤溶解 ⑥过 滤 ⑦蒸发
滤 ⑦蒸发
正确的操作顺序是 (填写序号)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
(5)用化学方程式回答加入Na2CO3溶液的作用:_____________________。
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:选择题
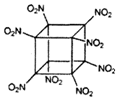 科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的气体.下列说法错误的是( )
科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的气体.下列说法错误的是( )| A. | 分子中C、N间形成极性共价键 | B. | 1mol该分子中含8mol-NO2 | ||
| C. | 该物质既有氧化性又有还原性 | D. | 该物质爆炸产物是NO2、CO2、H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有关苏糖的说法不正确的是( )
有关苏糖的说法不正确的是( )| A. | 苏糖能发生银镜反应 | |
| B. | 苏糖属于单糖 | |
| C. | 苏糖在一定条件下,能发生加成和取代反应 | |
| D. | 苏糖与葡萄糖互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁表面镀锌可增强其抗腐蚀性 | |
| B. | 为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 | |
| C. | “青蒿一握,以水二升渍,绞取汁”,上述对青篙素的提取过程属于物理变化 | |
| D. | 含重金属离子的电镀废液不能随意排放 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:选择题
①仅用蒸馏水就可鉴别蔗糖、硫酸铜粉未、碳酸钙粉未;
②用分液漏斗分离甘油和水的混合物;
③稀释浓硫酸时,将浓硫酸沿烧杯壁慢慢注入水中并不断搅拌;
④用玻璃棒蘸取溶液滴在pH试纸中央,测该溶液的pH;
⑤配制一定物质的量浓度的溶液,需要的玻璃仪器只有容量瓶和烧杯;
⑥在250mL烧杯中,加入216mL水和24g NaOH固体,配制10% NaOH溶液。
A. ①②④⑥ B. ①④⑤⑥ C. ①③④⑥ D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.| 时间(mol/L) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率:前者快,后者慢 | |
| B. | 消耗硝酸的物质的量:前者多,后者少 | |
| C. | 反应生成相同条件下气体的体积:前者多,后者少 | |
| D. | 反应中转移的电子总数:前者多,后者少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com