解答:解:(1)该反应的平衡常数表达式为K=
,故答案为:
;
(2)根据v=
=
=
=0.025mol/(L?min),速率之比等于化学计量数之比,所以有:v(O
2)=
v(SO
2)=0.0125mol/(L?min),
故答案为:0.0125mol/(L?min);
(3)温度升高,反应速率增大;温度升高,化学平衡正向移动,生成物的浓度增大,反应物的浓度减少,平衡常数增大;温度升高,化学平衡正向移动,混合气体的总物质的量增大,质量不变,摩尔质量减少,即平均相对分子质量减少;故答案为:增大;增大;减小;
(4)a、表示同一方向反应速率,v(SO
2)自始至终为v(O
2)的2倍,不能说明达到平衡,故a错误;
b、该反应前后气体体积变化,所以压强不变,反应已达到平衡状态,故b正确;
c、不同物质表示速率,到达平衡时,正逆速率之比等于化学计量数之比,v
逆(SO
2):v
正(O
2)=2:1,v
逆(SO
2)=2v
正(O
2),故c正确;
d、根据质量守恒,化学反应前后混合物的质量不变,容器体积不变,所以密度始终不变,故d错误;
故答案为:b、c;
(5)容器的体积减小,压强增大,平衡向逆反应方向移动,SO
3的物质的量增多,故答案为:c.

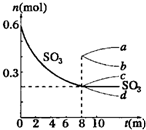 在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:
在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:
