
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2017届山东省高密市高三上学期10月统考化学试卷(解析版) 题型:选择题
NA代表阿伏伽德罗常数的值。K35ClO3与H37Cl反应后生成氯气、氯化钾和水。下列说法正确的是
A.生成氯气的相对分子质量为71 B.生成1 mol氯化钾转移6 NA个电子
C.生成氯化钾的摩尔质量为76 g/mol D.1molH37Cl参加反应转移NA个电子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东实验中学顺德学校高二上阶段质检化学试卷(解析版) 题型:选择题
某学习小组为了探究BrO3-+5Br-+6H+=3Br2+3H2O反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
实验编号 相关数据 | ① | ② | ③ | ④ | ⑤ |
c(H+)/ mol · L-1 | 0.008 | 0.008 | 0.004 | 0.008 | 0.004 |
c(BrO3-)/ mol· L-1 | 0.001 | 0.001 | 0.001 | 0.002 | 0.002 |
c(Br-)/ mol· L-1 | 0.10 | 0.20 | 0.20 | 0.10 | 0.40 |
v / mol· L-1· s-1 | 2.4×10-8 | 4.8×10-8 | 1.2×10-8 | 4.8×10-8 | v1 |
下列结论不正确的是( )
A.若温度升高到40℃,则反应速率增大
B.实验②、④,探究的是c(BrO3-)对反应速率的影响
C.若该反应速率方程为v =k ca(BrO3-)cb(Br-)cc(H+)(k为常数),则c =2
D.实验⑤中,v1 =4.8×10-8
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高一上第一次学段考试化学卷(解析版) 题型:推断题
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示:
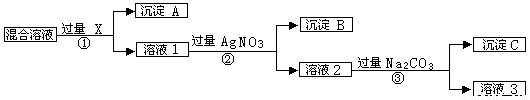
(1)写出下列物质的化学式X 、A __ 、B __
(2)上述实验流程中加入过量的Na2CO3的目的是_______________________。
(3)按此实验方案得到的溶液3中肯定含有___________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________(填化学式),之后若要获得固体NaNO3需进行的实验操作是___________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高一上第一次学段考试化学卷(解析版) 题型:选择题
相同条件下,1体积X2(气)和3体积Y2(气)生成2体积Z(气),则Z的化学式为( )
A.XY3 B.XY C.X2Y D.X3Y2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高一上第一次学段考试化学卷(解析版) 题型:选择题
我们的生活离不开化学。下列对化学生活的叙述,错误的是 ( )
A. “沙里淘金”是利用金与沙的密度相差较大而将沙淘走使金留下。
B. 化学上所指的 “杂质”,有的本来无害且很有价值,即使有害无价值的也应设法变废为宝。
C. 为了亲身体验物质的性质,我们有必要亲口尝一尝物质的味道。
D. 晾晒衣服实际上也是“蒸发”。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上第一次月考化学试卷(解析版) 题型:选择题
加热N2O5时,发生以下两个反应:N2O5?N2O3+O2,N2O3?N2O+O2.在1L密闭容器中加热4molN2O5,达到平衡时,c(O2)为4.5mol/L,c(N2O3)为1.62mol/L,则c(N2O5) 为( )
A.1.44mol/L B.3.48mol/L C. 0.94mol/L D. 1.98mol/L
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市如东县徐州市丰县高三10月联考化学卷(解析版) 题型:实验题
七铝十二钙 (12CaO·7Al2O3)是一种新型的超导材料和发光材料,它是用AlC13溶液溶解一定量的CaCO3形成溶液,再用氨水沉淀,然后锻烧沉淀制备。工业上制备AlC13溶液用图示流程(已知A1C13易升华)。

(1)轻烧后的气体用水处理前导气管为何要保温?
(2)用水处理添加的试剂X是 ,其目的是 。
(3)AlC13溶液溶解CaCO3时,要控制碳酸钙和AlC13的量,要求n(CaCO3): n(A1C13)> 12:14,其原因是 。用氨水沉淀、过滤后的滤液主要成分是 。
(4)以工业碳酸钙(含有少量A12O3、Fe3O4杂质)生产二水合氯化钙(CaC12·2H2O)的方法为:将工业碳酸钙溶于盐酸,加入双氧水, 。(实验中需用到的试剂和仪器有:盐酸,双氧水,氢氧化钙,冰水,pH计)。
已知:几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
开始沉淀的pH | 完全沉淀的pH | |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.5 | 4.7 |
补全实验步骤: 冰水洗涤,干燥,得到CaC12·2H2O。
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第一次联考化学试卷(解析版) 题型:实验题
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;  钴以Co2O3 ·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下:
钴以Co2O3 ·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下:

(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的离子反应方程式为(产物中只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸代替酸化的Na2S2O3,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因 。
(3)用离子方程式表示过程III和IV中Na2CO3的主要作用 。
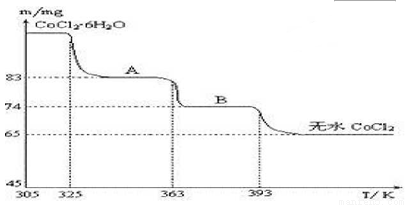
(4)CoO溶于盐酸可得粉红色的CoCl2溶液.CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2 吸水变色这一性质可制成变色水泥和显隐墨水.图2是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是 .
(5)某天然碱的化学式可表示为2Na2CO3·NaHCO3·2H2O,取少量该物质溶于水得稀溶液。下列有关该溶液中微粒的物质的量浓度关系 正确的是 (填序号)。
正确的是 (填序号)。
A.c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C.3c(Na+)>5c(CO32-)+5c(HCO3-)
D.将该溶液与少量NaOH 溶液混合:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
溶液混合:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com