
| A. | AlCl3溶液中通过量氨气:Al3++4OH-═AlO2-+2H2O | |
| B. | 过量铁与稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+3H2O | |
| C. | 氢氧化钠溶液中通过量二氧化硫:SO2+2OH-═SO32-+H2O | |
| D. | 溴化亚铁溶液与足量氯水反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
分析 A.不符合反应客观事实;
B.铁过量,反应生成硝酸亚铁;
C.二氧化硫过量,反应生成亚硫酸氢钠;
D.氯水足量,二价铁离子、溴离子都被氧化.
解答 解:A.AlCl3溶液中通过量氨气反应生成氢氧化铝和氯化铵,离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.过量铁与稀硝酸反应,离子方程式:3Fe+8H++NO3-═3Fe2++2NO↑+4H2O,故B错误;
C.氢氧化钠溶液中通过量二氧化硫,离子方程式:SO2+OH-═HSO3-,故C错误;
D.溴化亚铁溶液与足量氯水反应,离子方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故D正确;
故选:D.
点评 本题考查离子反应方程式的正误判断,明确发生的化学反应及离子反应的书写方法即可解答,注意反应为用量对反应的影响,注意离子反应遵循客观事实,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:Na2SX$?_{放电}^{充电}$ 2Na+XS (3<X<5)
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:Na2SX$?_{放电}^{充电}$ 2Na+XS (3<X<5)| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2PO4-+H+.
H2PO4-+H+.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 与1-己炔 ⑦
与1-己炔 ⑦ 和
和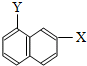 ⑧
⑧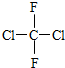 和
和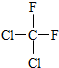
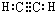 、C的结构简式:CH2=CH-CH=CH2、E的键线式:
、C的结构简式:CH2=CH-CH=CH2、E的键线式: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | ① | ② | ③ |
| 分子式 | C9H12 | C3H7OCl | C5H12O |
| 限定条件 | 芳香烃 | 含有羟基 | 不能与Na反应放出氢气 |
| A. | ③②① | B. | ②③① | C. | ③①② | D. | ②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +(8-$\frac{2}{3}$m) | B. | +(8-2m) | C. | +(8-$\frac{3}{2}$m) | D. | +(8-3m) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com