


 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
| A、变深 | B、先变深后变浅 |
| C、不变 | D、变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
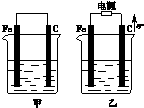 甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、a和b不连接时,铁片上发生的反应为:Cu2++Fe═Cu+Fe2+ |
| B、a和b用导线连接时,Cu2+向铁电极移动 |
| C、a和b分别连接直流电源正、负极,铜片会溶解 |
| D、无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1NaNO2 |
| 2维生素C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体粒子的直径介于1~100 nm之间 |
| B、胶体和溶液都是混合物,它们属于不同的分散系 |
| C、胶体都是胶状粘稠的液体 |
| D、利用丁达尔效应可鉴别胶体和溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com