
| A、将少量SO2气体通入氨水中:SO2+NH3?H2O═NH4++HSO3- |
| B、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
| C、用NaOH溶液吸收废气中氮氧化物:NO+NO2+OH-═NO3-+H2O |
| D、向稀硫酸加入少量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
| A、H2O分子和NH3分子具有相同数目的质子总数 | ||||
| B、18O和O2-是两种不同的核素 | ||||
C、H
| ||||
| D、14C和14N互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- |
| B、加入铝粉生成H2的溶液:K+、Mg2+、SO42-、HCO3- |
| C、c(Fe3+)=0.1mol?L-1的溶液:H+、Al3+、I-、SCN- |
| D、常温下pH=12的溶液:Na+、K+、SiO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、维生素C可将 Fe2+还原成为Fe3+ |
| B、亚硝酸盐被氧化 |
| C、亚硝酸盐是氧化剂 |
| D、维生素C是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气与水反应 Cl2+H2O═2H++Cl-+ClO- | ||||
| B、氢氧化钡溶液和稀硫酸反应:Ba2++SO42-═BaSO4↓ | ||||
| C、用FeCl3溶液腐蚀铜线路板:Cu+Fe3+═Cu2++Fe2+ | ||||
D、实验室检验溶液中存在铵根离子的方程式 NH4++OH-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素A、B、C、D、E在元素周期表中的位置如图所示,B是形成化合物种类最多的元素.
短周期元素A、B、C、D、E在元素周期表中的位置如图所示,B是形成化合物种类最多的元素.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某无色溶液中仅加入AgNO3溶液,以检验未知溶液中的Cl- |
| B、向某溶液中滴加稀硫酸生成无色气体,说明原溶液中有CO32- |
| C、向某无色溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42- |
| D、给盛有液体的烧瓶加热时,需要加碎瓷片或沸石 |
查看答案和解析>>
科目:高中化学 来源: 题型:
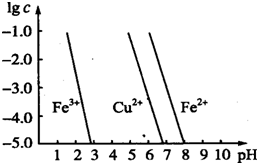 铁、氯、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题.
铁、氯、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题.| c(ClO2-) |
| c(HClO2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com