
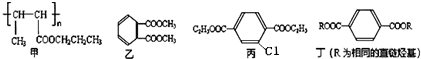
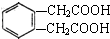 ;
;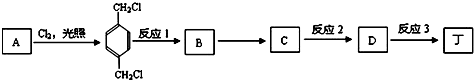
 .
.分析 (1)将链节中两个半键连接形成单键即得甲的单体;1.5mol甲含有1.5n mol酯基,酯基与氢氧化钠发生反应;
(2)由丙的结构简式,可知含有的官能团有酯基、氯原子;
(3)乙的同分异构体能与碳酸氢钠溶液反应释放出气体,说明含有羧基,且该同分异构体的核磁共振氢谱为1:1:1:2,应是含有2个取代基-CH2COOH且处于邻位;
(4)丁的含氧量(质量分数)为23%,丁分子中有四个氧原子,所以丁的相对分子质量为$\frac{64}{23%}$=278,所以丁中每个烃基的相对分子质量为57,R为直链烃基,所以烃基为-CH2CH2CH2CH3,丁为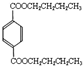 .A与氯气在光照的条件下发生取代反应生成
.A与氯气在光照的条件下发生取代反应生成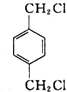 ,故A为
,故A为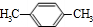 ,
, 在NaOH水溶液条件下生成水解反应生成B为
在NaOH水溶液条件下生成水解反应生成B为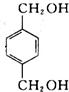 ,B在金属铜或银作催化剂、加热条件下,被氧气氧化生成C为
,B在金属铜或银作催化剂、加热条件下,被氧气氧化生成C为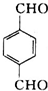 ,进一步发生氧化反应生成D为
,进一步发生氧化反应生成D为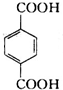 ,D与丁醇发生酯化反应生成丁.
,D与丁醇发生酯化反应生成丁.
解答 解:(1)将链节中两个半键连接形成单键,可得甲的单体为:CH3CH=CHCOOCH2CH2CH3,1.5mol甲含有1.5n mol酯基,酯基与氢氧化钠发生反应,1.5mol甲发生完全水解反应消耗NaOH的物质的量为1.5n mol,
故答案为:CH3CH=CHCOOCH2CH2CH3;1.5n mol;
(2)由丙的结构简式,可知含有的官能团有酯基、氯原子,
故答案为:酯基、氯原子;
(3)乙的同分异构体能与碳酸氢钠溶液反应释放出气体,说明含有羧基,且该同分异构体的核磁共振氢谱为1:1:1:2,应是含有2个取代基-CH2COOH且处于邻位,该同分异构体结构简式为: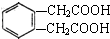 ,
,
故答案为: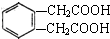 ;
;
(4)丁的含氧量(质量分数)为23%,丁分子中有四个氧原子,所以丁的相对分子质量为$\frac{64}{23%}$=278,所以丁中每个烃基的相对分子质量为57,R为直链烃基,所以烃基为-CH2CH2CH2CH3,丁为 .A与氯气在光照的条件下发生取代反应生成
.A与氯气在光照的条件下发生取代反应生成 ,故A为
,故A为 ,
, 在NaOH水溶液条件下生成水解反应生成B为
在NaOH水溶液条件下生成水解反应生成B为 ,B在金属铜或银作催化剂、加热条件下,被氧气氧化生成C为
,B在金属铜或银作催化剂、加热条件下,被氧气氧化生成C为 ,进一步发生氧化反应生成D为
,进一步发生氧化反应生成D为 ,D与丁醇发生酯化反应生成丁.
,D与丁醇发生酯化反应生成丁.
①根据上面的分析可知,反应1的反应条件是NaOH水溶液、加热,
故答案为:NaOH水溶液、加热;
②根据上面的分析可知,反应2的反应类型是氧化反应,
故答案为:氧化反应;
③反应3的化学方程式是 ,
,
故答案为: .
.
④X是B( )的同分异构体,满足如下条件的同分异构体:a.X能与FeCl3溶液发生显色反应,说明含有酚羟基,b.1molX与足量的Na反应可生成1molH2,说明含有2个羟基,c.苯环上的取代基不超过3个,含有2个取代基为-OH、-CH2CH2OH,或者为-OH、-CH(CH3)OH,各有邻、间、对3种,含有3个取代基为-OH、-CH3、-CH2OH,而-OH、-CH3有邻、间、对3种,对应-CH2OH分别有4种、4种、2种位置,3个取代基为2个-OH、1个-CH2CH3,而2个-OH有邻、间、对3种,对应-CH2CH3分别有2种、3种、1种位置,故符合条件的同分异构体共有19种,
)的同分异构体,满足如下条件的同分异构体:a.X能与FeCl3溶液发生显色反应,说明含有酚羟基,b.1molX与足量的Na反应可生成1molH2,说明含有2个羟基,c.苯环上的取代基不超过3个,含有2个取代基为-OH、-CH2CH2OH,或者为-OH、-CH(CH3)OH,各有邻、间、对3种,含有3个取代基为-OH、-CH3、-CH2OH,而-OH、-CH3有邻、间、对3种,对应-CH2OH分别有4种、4种、2种位置,3个取代基为2个-OH、1个-CH2CH3,而2个-OH有邻、间、对3种,对应-CH2CH3分别有2种、3种、1种位置,故符合条件的同分异构体共有19种,
故答案为:19.
点评 本题考查有机物的推断与合成、有机物的结构与性质、限制条件同分异构体的书写等,熟练掌握官能团的性质与转化,(4)④中同分异构体数目判断为易错点、难点,苯环的三元取代中注意利用定二移一法判断.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:填空题
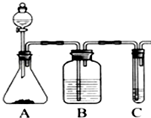 利用如图装置还可以验证醋酸、苯酚、碳酸的酸性强弱.
利用如图装置还可以验证醋酸、苯酚、碳酸的酸性强弱.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量SO2气体这入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HCLO | |
| B. | 向KHSO4溶液中加入Ba(OH)2溶液的pH=7:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 向Ca(H2PO4)2溶液中滴入过量的NaOH溶液:3Ca2++6H2PO4-+12OH-═Ca3(PO4)2↓+12H2O+$4PO_{4}^{-}}$ | |
| D. | 112mL(S.T.P)Cl2通入10ml1mol/L的FeBr2溶液:2Fe2++4Br-+3CL2═2Fe3++6Cl-+2Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
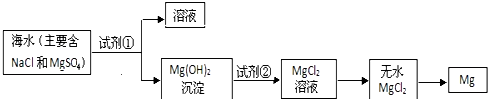
| 学生观点 | 是否正确 | 简述理由 |
| 观点 1 | 否 | 海水中镁离子浓度小,沉淀剂的用量大,不利于镁离子的沉淀 |
| 观点 2 | 否 | 能源消耗大,海水的综合利用低,成本高 |
| 观点 3 | 是 | 镁离子富集浓度高,成本低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+HNO3(浓)→Cu(NO3)2 | B. | Cu+HNO3(稀)→Cu(NO3)2 | ||
| C. | Cu $\stackrel{空气}{→}$CuO$\stackrel{HNO_{3}}{→}$ Cu(NO3)2 | D. | Cu$\stackrel{浓硫酸}{→}$CuSO4$\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z的物质的量之比为1:3:2 | |
| B. | 容器内的压强不再随时间变化 | |
| C. | 单位时间内每消耗1molX,同时消耗3molY | |
| D. | 混合气体的密度不再随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑦ | B. | ②④⑥ | C. | ①③⑤ | D. | ④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com