
| 实验步骤 | 预期的实验现象和结论 |
| 步骤:取一定量的固体产物于试管中,加入适量蒸馏水进行溶解,然后往试管中加入适量的 CuCl2溶液并过滤. | \ |
| 步骤2: 取1的滤液加入酚酞试液,若溶液变红, | 说明有NaOH |
| 步骤3: 取1的滤液加入BaCl2溶液,若产生白色沉淀, | 说明有Na2SO4 |
分析 (1)根据过滤操作的原理、使用的仪器进行分析即可;
(2)根据通过信息确定反应物、生成物,然后根据“产生等物质的量的CO和CO2”及化合价变化相等写出反应的化学方程式;
(3)硫化钠会水解,根据影响水解平衡的因素分析;
(4)由题意知,杂质成分有可能是NaOH和Na2SO4的混合物,验证NaOH,即验证OH-,可以用酚酞试液,验证Na2SO4,即验证SO42-,可用可溶性的钡盐,为防止干扰应先把S2-除去,所以步骤1中加入适量的CuCl2溶液,步骤2为取1的滤液加入酚酞试液,若溶液变红,则说明有NaOH,步骤3为取1的滤液加入BaCl2溶液,若产生白色沉淀,则说明有Na2SO4.
解答 解:(1)过滤需要的玻璃仪器有漏斗、烧杯、玻璃棒;
故答案为:漏斗、烧杯、玻璃棒;
(2)一定量的无水Na2S和碳粉进行隔绝空气高温灼烧,所得气体为等物质的量的CO和CO2,S元素被还原得到Na2S,反应方程式为3Na2SO4+8C$\frac{\underline{\;\;△\;\;}}{\;}$3Na2S+4CO2↑+4CO↑;
故答案为:3Na2SO4+8C$\frac{\underline{\;\;△\;\;}}{\;}$3Na2S+4CO2↑+4CO↑;
(3)Na2S是强碱弱酸盐,水解后溶液显碱性,加热会促进S2-水解,而加碱则可以抑制其水解,为不引入杂质,选择氢氧化钠;
故答案为:a;
(4)由题意知,杂质成分有可能是NaOH和Na2SO4的混合物,验证NaOH,即验证OH-,可以用酚酞试液,验证Na2SO4,即验证SO42-,可用可溶性的钡盐,为防止干扰应先把S2-除去,所以:
步骤1:取一定量的固体产物于试管中,加入适量蒸馏水进行溶解,然后往试管中加入适量的CuCl2溶液并过滤;
步骤2:取1的滤液加入酚酞试液,若溶液变红,则说明有NaOH;
步骤3:取1的滤液加入BaCl2溶液,若产生白色沉淀,则说明有Na2SO4;
故答案为:NaOH和Na2SO4;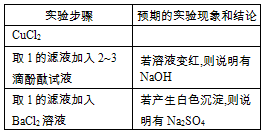 .
.
点评 本题考查了Na2S的制备实验,涉及对操作的分析评价、对条件的控制、实验设计等,侧重考查学生理论联系实际的能力、阅读获取信息的能力、知识迁移应用,难度中等,意在考查考生对信息的挖掘能力及实验探究能力.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④ | B. | ①=②=③=④ | C. | ①=②=③>④ | D. | ①>②>③=④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同种元素的原子均有相同的质子数和中子数 | |
| B. | 全部由非金属元素组成的化合物中只含共价键 | |
| C. | ⅦA族元素是同周期中非金属性最强的元素 | |
| D. | 同一主族的元素,原子半径越大,其单质的熔点一定越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为黄色固体,易溶在XZ2中,p是一种二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )
短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为黄色固体,易溶在XZ2中,p是一种二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )| A. | 原子半径:W<X<Y | |
| B. | W与X组成的化合物中可能含有极性键和非极性键 | |
| C. | Y与Z组成的化合物一定有漂白性 | |
| D. | W与X、Y、Z组成的简单化合物的稳定性:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
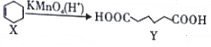 ,下列说法错误的是( )
,下列说法错误的是( )| A. | X分子中所有碳原子一定在同一平面上 | |
| B. | X与乙烯不属于同系物 | |
| C. | Y可发生取代反应、氧化反应 | |
| D. | Y的含有相同官能团的同分异构体有8种(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 电极反应式 | 出现的环境 |
| A | O2+2H2O+4e-═4OH- | 碱性环境下氢氧燃料电池的负极反应 |
| B | 4OH--4e-═O2↑+2H2O | 弱酸性环境下钢铁的吸氧腐蚀 |
| C | Cu-2e-═Cu2+ | 用铜做电极电解NaOH溶液的阳极反应 |
| D | H2-2e-═2H+ | 用惰性电极电解H2SO4溶液的阳极反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应完全停止 | B. | 各物质的浓度保持不变 | ||
| C. | 反应物消耗完全 | D. | 正反应速率大于逆反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com