
| A、氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O |
| B、氯气溶于水:Cl2+H2O=2H++ClO-+Cl- |
| C、溴化亚铁溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| D、向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |


科目:高中化学 来源: 题型:
| 0.01mol?L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol?L-1Na2SO3 溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ag+、Ca2+、Cl-、SO42- |
| B、Fe2+、H+、SO32-、ClO- |
| C、Mg2+、NH4+、Cl-、SO42- |
| D、K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化铁中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| B、铝粉溶于氢氧化钠溶液中:Al+2OH-=AlO2-+H2↑ |
| C、在酸性的硫酸亚铁溶液中加入双氧水:2Fe2++H2O2+2H+=2Fe3++2H2O |
| D、硫化氢气体通入氯化铁溶液中:Fe3++H2S=Fe2++S↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
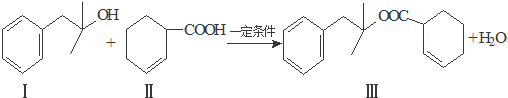
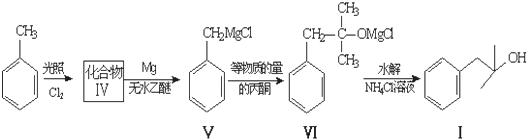
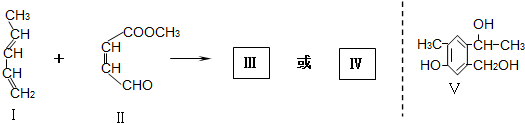
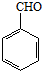 也能发生类似V→I的反应,请写出生成醇的结构简式
也能发生类似V→I的反应,请写出生成醇的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
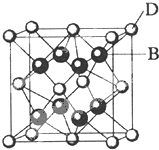 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.查看答案和解析>>
科目:高中化学 来源: 题型:
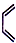 ;
;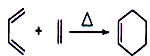
| Br2/CCl4 |
| ① |

| NaOH/醇溶液,△ |
| ② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com