
 实验室以苯甲醛为原料,通过Cannizzaro反应来制备苯甲醇和苯甲酸.反应式如下:
实验室以苯甲醛为原料,通过Cannizzaro反应来制备苯甲醇和苯甲酸.反应式如下: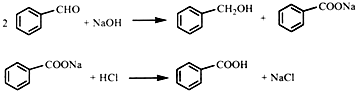
| 名称 | 分子量 | 性状 | 相对密度 (g•cm-3) | 熔点 (℃) | 沸点 (℃) | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.06 | -26 | 179.6 | 微溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 针状结晶 | 1.27 | 122.1 | 249 | 0.21g | 46.6g | 66g |
| 苯甲醇 | 108 | 无色液体 | 1.04 | -15.3 | 205.7 | 微溶 | 易溶 | 易溶 |
| 乙醚 | 74 | 无色液体 | 0.71 | -116.3 | 34.6 | 不溶 | 易溶 | 一 |
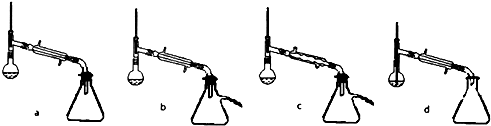
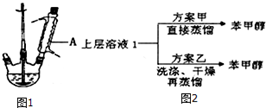
分析 (1)由仪器结构特征,可知a为球形冷凝管;
(2)乙醚的沸点为34.6℃,低温蒸出乙醚,蒸馏乙醚时最好采用水浴加热;温度计应在蒸馏头支管口处,控制收集馏分的温度,装置不能完全密闭,防止炸裂危险,还要防止产物挥发,球形冷凝管主要应用于有机化合物的合成装置中的回流,一般用于反应装置,球形有利于增加冷却接触面,故冷凝面积较直形冷凝管大,冷凝效率稍高,直形冷凝管主要应用于混合液体或液-固体系中沸点不同各组分物质的蒸馏实验中的冷凝,蒸馏是要某物质蒸气冷凝成液体后流出,直形是为了方便液体的流出;
(3)a.上层液中还含有未反应的苯甲醛;
b.加入10%的Na2CO3溶液除去生成的苯甲酸;
(4)根据苯甲醇的沸点控制蒸馏温度;苯甲酸在水中溶解度很小,加入盐酸会析出苯甲酸,进行过滤分离;
(5)根据苯甲醛计算苯甲酸的理论产量,产率=$\frac{实际产量}{理论产量}$×100%.
解答 解:(1)由仪器结构特征,可知a为球形冷凝管,
故答案为:球形冷凝管;
(2)乙醚的沸点为34.6℃,低温蒸出乙醚,蒸馏乙醚时最好采用水浴加热,
装置不能完全密闭,防止炸裂危险,故a错误,还要防止产物挥发,球形冷凝管主要应用于有机化合物的合成装置中的回流,一般用于反应装置,球形有利于增加冷却接触面,故冷凝面积较直形冷凝管大,冷凝效率稍高,直形冷凝管主要应用于混合液体或液-固体系中沸点不同各组分物质的蒸馏实验中的冷凝,蒸馏是要某物质蒸气冷凝成液体后流出,直形是为了方便液体的流出,而球形冷凝管不利于液体流出,故c错误,温度计应在蒸馏头支管口处,控制收集馏分的温度,故d错误,
故选:b;
(3)a.上层液中还含有未反应的苯甲醛,饱和NaHSO3溶液的作用是:除去苯甲醛,
故答案为:除去苯甲醛;
b.加入10%的Na2CO3溶液除去生成的苯甲酸,没有气泡生成时说明杂质已被除尽,
故答案为:无气泡产生;
(4)苯甲醇的沸点为205.7℃,控制蒸馏温度为205.7℃;苯甲酸在水中溶解度很小,加入盐酸会析出苯甲酸,进行过滤分离,
故答案为:205.7℃;过滤;
(5)15.0mL苯甲醛的质量为15.0mL×1.06g/mL,其物质的量为$\frac{15mL×1.06g/mL}{106g/mol}$=0.15mol,由方程式可知生成苯甲酸为$\frac{0.15mol}{2}$=0.075mol,故苯甲酸的产率为$\frac{7.50g}{0.075mol×122g/mol}$×100%=81.97%,
故答案为:81.97%.
点评 本题考查有机物制备实验,侧重考查学生对原理及操作的分析评价、物质的分离提纯、仪器的识别与用途等,关键是充分利用题目给予的信息进行解答,较好的考查学生分析推理能力、知识迁移运用能力,题目难度中等.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:解答题
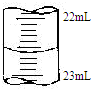 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
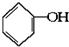 合成
合成 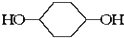 .(部分试剂和反应条件已略去)已知D为1,3-环己二稀
.(部分试剂和反应条件已略去)已知D为1,3-环己二稀

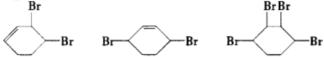 .
.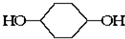 的一种同分异构体可发生银镜反应,也可以水解,核磁共振氢谱显示有三个峰,其面积比为1:2:9,该同分异构体的结构简式为HCOOCH2C(CH3)3
的一种同分异构体可发生银镜反应,也可以水解,核磁共振氢谱显示有三个峰,其面积比为1:2:9,该同分异构体的结构简式为HCOOCH2C(CH3)3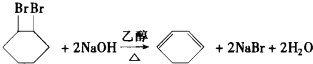 (有机物写结构简式,并注明反应条件)
(有机物写结构简式,并注明反应条件)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
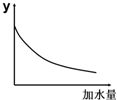
| A. | 溶液的pH | B. | 溶液的导电能力 | ||
| C. | 醋酸的电离平衡常数 | D. | 醋酸的c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
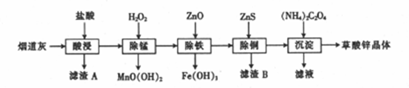
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 1.9 | 6.5 | 4.2 | 5.4 |
| 完全沉淀时的pH | 3.3 | 9.7 | 6.7 | 8.2 |
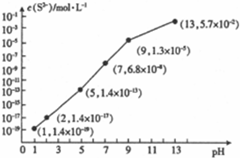
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
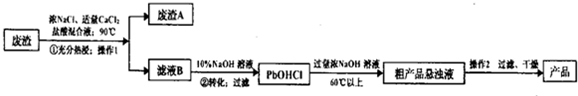
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碘化钾溶液中加入用硫酸酸化的过氧化氢溶液:2I-+H2O2═I2+2OH- | |
| B. | 在亚硫酸中加入过量的次氯酸钠溶液:H2SO3+ClO-═Cl-+2H++SO42- | |
| C. | 向Ba(OH)2溶液中加入过量NH4HSO4:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | Fe2O3溶于过量的氢碘酸中:Fe2O3+6H+═2Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:X的氢化物>Y的氢化物>Z的氢化物 | |
| B. | X、Y、M三种元素可形成离子化合物 | |
| C. | 简单离子的半径:M的离子>Z的离子>Y的离子>X的离子 | |
| D. | Z元素的最高价氧化物的水化物的化学式为HZO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(乙醇)、KOH | B. | 金刚石、MgF2 | C. | H2SO4、Na2SO4 | D. | P4和CCl4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com