
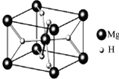
 MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度ag?cm-3,则晶胞的体积为
MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度ag?cm-3,则晶胞的体积为 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
| A、pH=11的溶液 |
| B、c(OH-)=0.01mol/L的溶液 |
| C、1L溶液中含有4gNaOH的溶液 |
| D、c(H+)=1×10-10mol/L的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、工业上通过电解熔融状态MgCl2制取金属镁 |
| B、用澄清的石灰水可鉴别NaHCO3和Na2CO3 |
| C、在第②、④步骤中,溴元素均被氧化 |
| D、制取NaHCO3的反应是利用其溶解度小于NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 盐酸 |
| ① |
| 稀硝酸、盐酸 |
| ② |
| ③ |
| 品 名 | 氯化亚铁 |
| 理化特性 | 白色,遇空气易变成黄色,易吸水,有腐蚀性… |
| 注意事项 | 避免接触空气、碱等;聚乙烯塑料桶包装;避免受热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
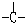 和一个-Cl,它可能的结构有四种,试写出其中的三种结构简式.
和一个-Cl,它可能的结构有四种,试写出其中的三种结构简式.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com