
(1)写出①②和③步所有反应的化学方程式:

_____________________________________;______________________________________。
_____________________________________;______________________________________。_____________________________________;______________________________________。
(2)设从③步所得固体D的质量为
解析:X溶于过量的HCl,故A为FeCl2、CuCl2、HCl的混合溶液。X与过量的CO反应,固体产物为Fe和Cu,气体为CO2,而B能与A反应,故B为Fe和Cu的混合物。B与A反应的溶液呈酸性,说明HCl还有余,故固体D中只有Cu,而气体F为H2,E为FeCl2和HCl的混合溶液。显然,固体D的质量为
答案:(1)①FeO+2HCl![]() FeCl2+H2O CuO+2HCl
FeCl2+H2O CuO+2HCl![]() CuCl2+H2O
CuCl2+H2O
②FeO+CO![]() Fe+CO2 CuO+CO
Fe+CO2 CuO+CO![]() Cu+CO2
Cu+CO2
③CuCl2+Fe![]() FeCl2+Cu Fe+2HCl
FeCl2+Cu Fe+2HCl![]() FeCl2+H2↑
FeCl2+H2↑
(2)


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
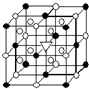 A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子
A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
| 80m-135n |
| 18n |
| 80m-135n |
| 18n |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 2 |
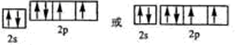
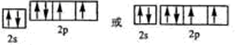
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com