
| A、0.6 g |
| B、1.2 g |
| C、2.4 g |
| D、3.6 g |
| 0.17g |
| 17g/mol |


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
| A、加入醋酸钠,平衡向左移动 |
| B、加入碳酸钠,平衡向右移动 |
| C、加水稀释,C(H+)减小 |
| D、加水稀释,溶液中仅有的三种离子浓度都减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某物质熔化时不导电,则该物质为弱电解质 |
| B、某物质不是离子化合物,而是极性共价化合物,则该物质为弱电解质 |
| C、某一元酸2 mol与足量Zn完全反应生成1 molH2,则该酸为强酸 |
| D、溶液中已电离的离子和未电离的分子共存,则该物质为弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
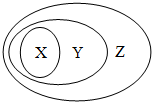 用下图表示的一些物质或概念间的从属关系中不正确的是( )
用下图表示的一些物质或概念间的从属关系中不正确的是( )| X | Y | Z | |
| A | 氧化物 | 化合物 | 纯净物 |
| B | 金属单质 | 单质 | 纯净物 |
| C | 碱性氧化物 | 金属氧化物 | 氧化物 |
| D | 化合物 | 酸 | 硫酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CaCO3
| ||||
B、2NaHCO3
| ||||
| C、Cl2+H2O═HCl+HClO | ||||
| D、H2+Cl2═2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.8 g Na2O2中含有的阴离子数目为0.2 NA |
| B、常温常压下,氧气和臭氧的混合物16 g中含有NA个氧原子 |
| C、32 g Cu与足量的硫蒸气充分反应,电子转移总数为NA |
| D、在标准状况下,11.2 L SO3含分子数0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 0.2mol?L-1的KCl溶液 |
| B、0.2L 0.1mol?L-1的盐酸溶液 |
| C、0.1L 0.1mol?L-1的AlCl3溶液 |
| D、0.3L 0.1mol?L-1的MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3比NaHCO3易溶于水 |
| B、相同质量的Na2CO3和NaHCO3分别与足量盐酸反应,Na2CO3放出CO2多 |
| C、Na2CO3和NaHCO3都能跟石灰水反应得到白色沉淀 |
| D、相同物质的量的Na2CO3和NaHCO3分别与足量盐酸反应得CO2的物质的量之比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com