
| A. | 41.8 g固体物质为Na2CO3 | |
| B. | 41.8 g固体物质为0.1 mol Na2CO3和0.4 mol Na2O2的混合物 | |
| C. | 41.8 g固体物质为31.2 g NaHCO3和10.6 g Na2CO3的混合物 | |
| D. | 一定量的Na2O2为78 g |
分析 盐酸中和含氯化氢的物质的量为:1L×1mol/L=1mol,反应后固体恰好与1mol氯化氢反应,反应后溶质为氯化钠,原固体中含有1mol钠离子,根据钠离子守恒,原过氧化钠的物质的量为:$\frac{1mol}{2}$=0.5mol,其质量为:78g/mol×0.5mol=39g;
若全部反应生成碳酸钠,其物质的量为:$\frac{1mol}{2}$=0.5mol,质量为:106g/mol×0.5mol=53g>41.8g,
若全部为过氧化钠,质量为39g<41.8g,
所以41.8g为碳酸钠和过氧化钠的混合物,由于二者的化学式中都含有2个钠离子,则二者的总物质的量为0.5mol,
设混合物中含碳酸钠的物质的量为x,过氧化钠的物质的量为:0.5mol-x,106g/mol×x+78g/mol×(0.5mol-x)=41.8g,
解得:x=0.1mol,则剩余的过氧化钠的物质的量为:0.5mol-0.1mol=0.4mol,据此进行解答
解答 解:盐酸中和含氯化氢的物质的量为:1L×1mol/L=1mol,反应后固体恰好与1mol氯化氢反应,反应后溶质为氯化钠,原固体中含有1mol钠离子,
反应后的固体可能组成为:①碳酸钠,②碳酸钠和过氧化钠的混合物,③碳酸钠和碳酸氢钠的混合物,
若全部反应生成碳酸钠,其物质的量为:$\frac{1mol}{2}$=0.5mol,质量为:106g/mol×0.5mol=53g>41.8g,
若全部为过氧化钠,则过氧化钠的物质的量为 $\frac{1mol}{2}$=0.5mol,质量为:78g/mol×0.5mol=39g<41.8g,
故41.8g为碳酸钠和过氧化钠的混合物,由于二者的化学式中都含有2个钠离子,则二者的总物质的量为
0.5mol,
设反应后的混合物中含碳酸钠的物质的量为x,则含有过氧化钠的物质的量为:(0.5mol-x),
根据反应后固体总质量可得:106g/mol×x+78g/mol×(0.5mol-x)=41.8g,
解得:x=0.1mol,即:反应生成碳酸钠为0.1mol,则反应后剩余的过氧化钠的物质的量为:
0.5mol-0.1mol=0.4mol,
A.根据分析可知,剩余的固体为碳酸钠和过氧化钠的混合物,故A错误;
B.根据计算可知,41.8g固体物质为0.1mol Na2CO3和0.4mol Na2O2的混合物,故B正确;
C.根据分析可知,反应后固体为碳酸钠和过氧化钠的混合物,不存在碳酸氢钠,故C错误;
D.根据钠离子守恒,原过氧化钠的物质的量为:1mol2=0.5mol,质量为:78g/mol×0.5mol=39g,故D错误;
故选B.
点评 本题考查了混合物反应的计算,题目难度中等,根据质量守恒定律利用极值法正确判断反应后固体组成为解答关键,注意掌握质量守恒定律在化学计算中的应用方法.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
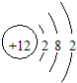
| A. | 该元素位于第三周期第ⅡA族 | B. | 该元素属于非金属元素 | ||
| C. | 该原子有3个电子层 | D. | 该原子最外层有2个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
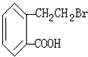 ,A可以发生如下化学反应:
,A可以发生如下化学反应: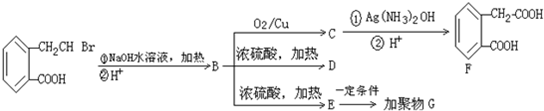
 ,B生成D的化学方程式为
,B生成D的化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32-)+c(OH-) | |
| B. | 0.1mol/L醋酸钠溶液20ml与0.1mol/L盐酸10ml混合后的溶液中:c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | 物质的量浓度相等的①NH4Cl、②(NH4)2SO4、③NH4Al(SO4)2三种溶液中,c(NH4+)由大到小的顺序为:③>②>① | |
| D. | 浓度为0.1mol/L的①氨水、②C6H5ONa溶液、③Na2CO3溶液、④NaHCO3溶液,pH的大小顺序:①>④>③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ Ag+ OHˉ NO3- | B. | Na+ Cu2+ SO42- NO3- | ||
| C. | Mg2+ Na+ SO42- Cl- | D. | Ba2+ K+OH-HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
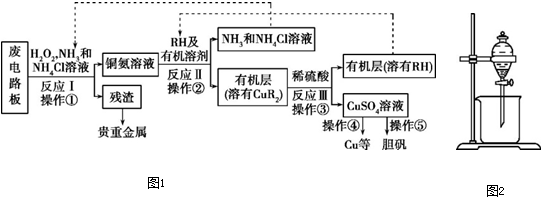
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl受热不分解,H2S受热分解 | |
| B. | 往H2S溶液中通入氯气,生成硫和氯化氢 | |
| C. | 与Cu化合时,硫显-2价,氯显-1价 | |
| D. | Cl、S原子的电子层数相同,且Cl原子半径比S原子半径小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com