
【题目】下表列出了某短周期元素R的各级电离能数据(单位为kJ·mol-1)。下列关于元素R的判断中一定正确的是( )
I1 | I2 | I3 | I4 | …… | |
R | 577.5 | 1816.7 | 2744.8 | 11577 |
①R的主要化合价中最高正价为+3价 ②R元素位于元素周期表中第ⅡA族
③R元素第一电离能小于同周期相邻元素 ④R元素基态原子的电子排布式为1s22s22p1
A. ①② B. ②③ C. ③④ D. ①③
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】利用化学反应将储存在物质内部的化学能转化为电能,科学家设计出了原电池,从而为人类生产、生活提供能量。
(1)甲同学认为,所有的氧化还原反应都可以设计成原电池,你是否同意?________(填“是”或“否”)。
(2)乙同学依据氧化还原反应:2Ag++Cu===Cu2++2Ag设计的原电池如图所示:

①负极材料是_______,发生的电极反应为____________________________;
②外电路中的电子是从________电极流向________电极。(写出电极材料的名称)
③当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4 g,则该原电池反应共转移的电子数目是________。
Ⅱ.水是生命之源,也是化学反应中的主角。请回答下列问题:
(1)已知:2 mol H2完全燃烧生成液态水时放出572 kJ的热量。
①生成物的能量总和________(填“>”“<”或“=”)反应物的能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量________(填“>”“<”或“=”)572 kJ。
③每克氢气燃烧生成液态水时放出的热量为________。
(2)天然气(主要成分CH4)和氧气反应生成二氧化碳和水,该反应为放热的氧化还原反应,可将其设计成燃料电池,构造如图所示,a、b两个电极均由多孔的碳块组成。

a电极的电极反应式是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为减少煤炭燃烧过程 SO2 的排放,可采用固硫技术把 SO2 转化为 CaSO4的形式固定。已知:
CaSO4(s)+CO(g) ![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol (Ⅰ)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol (Ⅰ)
CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g), △H2=-175.6 kJ/mol (Ⅱ)
CaS(s)+4CO2(g), △H2=-175.6 kJ/mol (Ⅱ)
2CO(g)+O2![]() 2CO2(g) △H3=-566.0 kJ/mol (III)
2CO2(g) △H3=-566.0 kJ/mol (III)
(1)写出用 CaO(s)固硫转化为 CaSO4(s)的热化学方程式____________。
(2)煤炭燃烧过程中产生的 CO 与 CaSO4 反应, 降低脱硫效率。研究表明,在相同温度温度下,反应Ⅰ的速率远大于反应Ⅱ的速率,请说明理由__________;在同一个图中画出反应Ⅰ和反应Ⅱ的反应过程与能量变化示意图。_____________
(3)下列措施有助于反应(I)向逆反应方向移动的是__________。
A.升高温度 B.鼓入一定量 CO2 C.鼓入一定量 O2 D.加入负催化剂
(4)用 NaOH 溶液吸收足量的 SO2得到 NaHSO3 溶液, 以 Pt 为电极电解 NaHSO3溶液可制得硫酸。 请写出阳极的电极反应式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用无水 Na2SO3固体配制 250 mL 0.1000 mol·L-1 溶液的步骤如下图,请回答:
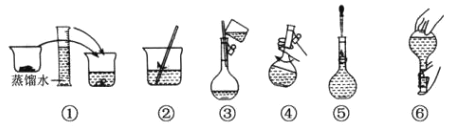
(1)在配制过程中必要的仪器有:烧杯、玻璃棒、胶头滴管、 250ml 容量瓶和____________;检验容量瓶是否漏水的操作方法是____________________________________。
(2)下列操作不会对所配的Na2SO3溶液浓度产生误差的是__________。
A.容量瓶刚用蒸馏水洗净,没有烘干
B.图③没有用蒸馏水洗烧杯 2-3 次,并转移洗液
C.图⑤时仰视容量瓶的刻度线
D.图⑥后,发现液面略低于刻度线,再滴加少量水使液面凹面与刻度线相切
(3)已知亚硫酸钠在空气中能被氧气氧化生成硫酸钠,请设计实验检验配制的 Na2SO3 溶液是否发生变质_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示实验装置用于验证某些物质的性质。在试管A中装入足量的固体NaHCO3,D为固定蚊香的硬纸片。试回答下列问题:

(1)在A试管内发生反应的化学方程式是__________________________________。
(2)B装置的作用是____________。
(3)在双球干燥管内发生反应的化学方程式为___________________,该反应中氧化剂为________,氧化产物为________,每有1molNa2O2发生反应,转移电子数目为________。
(4)双球干燥管内观察到的实验现象是________________________________________________;上述实验现象说明________________________________________________________________。
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)把标准状况下VL气体(摩尔质量为Mg·mol-1)溶于1L水中(不考虑反应),所得溶液密度为ρg/cm3,则此溶液的物质的量浓度为_________________mol/L;
(2)把100mL0.3mol/LNa2SO4溶液和400mL0.2mol/LNaCl溶液混合后,溶液中Na+的物质的量浓度为_____________________
(3)一定质量的Al与足量盐酸反应,当转移了2 mol电子时,参与反应的铝的质量是________g。
(4)下列物质:①Fe ②NaCl ③Na2O ④CO ⑤CO2 ⑥蔗糖 ⑦NH3 ⑧NaCl溶液 ⑨盐酸 ⑩ H2SO4 Ba(OH)2
属于电解质的是_______ , 属于非电解质的是 ________,能导电的是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如右图所示,下列说法正确的是

A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. 每生成1mol铁锈(Fe2O3·xH2O)理论上消耗标准状况下的O233.6L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com