
【题目】氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将 6.00 g 甲加热至完全分解,只得到一种常见金属单质和 6.72 L 的 H2(已折算成标准状况)。甲与水反应也能放出H2,同时还产生一种白色沉淀物,该白色沉淀既可以溶于盐酸,也可溶于 NaOH 溶液。化合物乙在催化剂存在下可分解得到H2 和另一种单质气体丙,丙在标准状况下的密度为1.25 g·L-1。请回答下列问题:
(1)甲是_______________;乙是______________。( 填化学式)
(2)甲与水反应的化学方程式是____________。
(3)气体丙的分子式是____________。
(4)乙在加热条件下可与 CuO 发生反应,生成红色固体和气体丙,写出该反应的化学方程式________________。
(5)有人提出产物Cu中可能还混有Cu2O,请设计实验方案验证:__________________。
(已知:Cu2O+2H+=Cu+Cu2++H2O;Cu、Cu2O 均可以溶解在 HNO3 溶液中)
(6)甲与乙之间_____________ (填“可能”或“不可能”)发生反应产生H2,判断理由是_______________。
【答案】(1)AlH3 NH3
(2)AlH3+3H2O=Al(OH)3↓+3H2(3)N2
(4)2NH3+3CuO![]() 3Cu+N2+3H2O
3Cu+N2+3H2O
(5)取样后加稀硫酸(或稀酸) ,如果溶液变蓝,说明产物中含有 Cu2O,反之则无 Cu2O
(6)可能AlH3 和NH3 中氢化合价分别为-1价和+1价,一定条件下可发生归中生成H2
【解析】
试题分析:(1)6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L H2(即0.3 mol),说明甲为金属氢化物。甲与水反应生成的白色沉淀物可溶于NaOH溶液,则该沉淀物为Al(OH)3,结合甲分解过程中的质量变化,可推知甲为AlH3。单质气体丙在标准状况下的密度为1.25 g·L-1,则M(丙)=1.25 g·L-1×22.4 L·mol-1=28 g·mol-1,则丙为N2,乙为NH3。
(2)AlH3与水反应生成Al(OH)3和H2,反应的化学方程式为AlH3+3H2O=Al(OH)3+3H2↑。
(3)根据以上分析可知丙是N2。
(5)NH3具有还原性,与CuO在加热条件下发生反应,生成Cu、N2和H2O,反应方程式为2NH3+3CuO![]() 3Cu+N2+3H2O。由于Cu2O在酸性环境中可发生自身氧化还原反应,生成Cu2+和Cu,可向产物中滴加稀盐酸或稀硫酸,由于Cu与非氧化性酸不发生反应,若得到蓝色溶液,则证明含有Cu2O,反之则不含Cu2O。
3Cu+N2+3H2O。由于Cu2O在酸性环境中可发生自身氧化还原反应,生成Cu2+和Cu,可向产物中滴加稀盐酸或稀硫酸,由于Cu与非氧化性酸不发生反应,若得到蓝色溶液,则证明含有Cu2O,反之则不含Cu2O。
(6)AlH3中H元素为-1价,NH3中H元素为+1价,根据氧化还原反应规律,二者可能发生价态归中的氧化还原反应,生成H2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置制备AlCl3溶液,并用AlCl3溶液溶解一定量的CaCO3形成溶液,再用氨水沉淀,然后煅烧沉淀制备新型的超导材料和发光材料七铝十二钙(12CaO·7Al2O3)。已知AlCl3易水解,易升华。

(1)实验室用氯酸钾和浓盐酸制备氯气,其离子方程式为 ;C装置的作用 。
(2)氯气与废铝屑反应生成的AlCl3蒸气溶解在B中浓盐酸,为了防止AlCl3蒸气凝华堵塞导管,实验中可采取的措施是 (写出一点)。
(3)AlCl3溶液溶解CaCO3时,AlCl3溶液和碳酸钙粉末的混合方式为 。
(4)实验要控制碳酸钙和AlCl3的量,要求n(CaCO3)∶n(AlCl3)> 。
(5)用白云石(主要成分为CaCO3、MgCO3)制备纯净碳酸钙的实验方案为:将一定量的白云石煅烧, 。(实验中需用到的试剂有:硝酸铵溶液,氨气,二氧化碳;需要用到的仪器:pH计。已知:镁的化合物不溶于硝酸铵溶液;pH值为11~12时得到较纯净碳酸钙沉淀)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.二次电池的放电与充电属于可逆反应
B.碱金属单质在空气中燃烧都生成过氧化物
C.在周期表中,族序数都等于该族元素的最外层电子数
D.在周期表过渡元素中寻找催化剂恒和耐腐蚀、耐高温的合金材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:
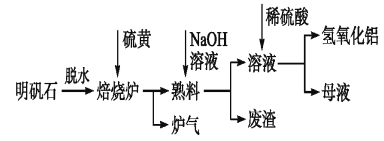
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S![]() 2Al2O3+9SO2,该反应的氧化剂是___________;若生成1 mol Al2O3,则转移的电子数为__________________。
2Al2O3+9SO2,该反应的氧化剂是___________;若生成1 mol Al2O3,则转移的电子数为__________________。
(2)熟料溶解时,反应的离子方程式为________________。
(3)母液中溶质主要成分为__________。(填化学式)
(4)检验废渣中主要成分的方法:
①操作__________________________,
②现象__________________________,
③结论__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A、工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B、合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率;
C、在实验室里,可用碳酸钙粉末和稀盐酸制得二氧化碳气体;
D、实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. He的中子数是2
B. 白磷、红磷互为同素异形体
C. 18O和16O互为同位素
D. 正丁烷和异丁烷互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com