
【题目】下面是某化学兴趣小组的同学学习元素周期律时设计的两套实验方案。
(实验一)实验步骤如下:
向新制的Na2S溶液中滴加新制的氯水
设计该实验方案的目的是:探究同周期元素的性质递变规律。
(1)实验①的现象是_____________________,反应的离子方程式是_________________。
(实验二)为验证Cl、Br的非金属性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如图.
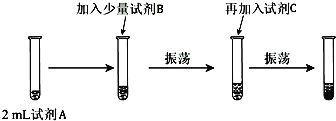
(2)试剂A是NaBr溶液,试剂B是氯水,加C后出现分层,则试剂C是____________.
(3)加入C振荡、静置后看到的现象是:______________________________________。以上反应可以证明Cl的非金属性__________(填“强于”或“弱于”)Br的非金属性。
【答案】有淡黄色沉淀生成 Cl2+S2-=2Cl-+S↓ CCl4 分层,下层紫红色 强于
【解析】
(1)氯水与硫化钠反应生成S与NaCl,S为淡黄色且不溶;【实验二】根据同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性来设计实验。
(1)由于氯元素的非金属性强于硫元素,所以Cl2可以置换S,实验①的现象是有淡黄色沉淀生成,反应的离子方程式是Cl2+S2-=2Cl-+S↓;
答案:有淡黄色沉淀生成 Cl2+S2-=2Cl-+S↓
【实验二】
根据同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性来设计实验,氯气可以置换溴,再加入萃取剂萃取观察现象;
(2)因为酒精和水任意比互溶,不可做萃取剂;因为四氯化碳与水互不相溶,与溶液互不反应,溴在四氯化碳中的溶解度远远大于在水中的溶解度,所以选择四氯化碳为萃取剂;
答案:CCl4
(3)因为四氯化碳密度比水大,加入四氯化碳振荡、静置后看到的现象是:分层,下层呈紫红色。以上反应可以证明Cl的非金属性强于Br的非金属性;
答案:分层,下层紫红色 强于


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】化学在日常生活和生产中有着重要的应用。下列说法不正确的是( )
A. 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B. 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为溶液中的SO32—水解
C. 将饱和FeCl3溶液滴入沸水中可制备Fe(OH)3胶体,利用的是盐类水解原理
D. 纯碱溶液呈碱性的原因是CO32—+H2O![]() HCO3—+OH-
HCO3—+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性KMnO4、H2O2在生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸(H2C2O4)去除,Fe(NO3)3也是重要的氧化试剂,下面是对这三种氧化剂性质的探究。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的离子方程式____________________,氧化产物与还原产物的物质的量之比为_______。
(2)取300 mL 0.2 mol·L-1的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量是_____ mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的原因是_________________(用文字表达),又变为棕黄色的离子方程式是_____________________。
(4)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,取0.474 g KMnO4样品溶解酸化后,用0.100 mol·L-1标准Na2S2O3溶液进行滴定,标准Na2S2O3溶液应盛装在___(填“酸式”或“碱式”)滴定管中。配平上述反应的离子方程式:___MnO4-+___S2O32-+____H+=____Mn2++_____SO42-+____H2O,实验中,滴定至终点时消耗Na2S2O3溶液12.00 mL,则该样品中KMnO4的物质的量是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。M元素与X同主族,与W同周期。
(1) Z、W形成的气态氢化物的稳定性为___________>___________,(填化学式)写出下列元素的名称:X_______、W_______,Z、M、W三种元素离子半径由大到小的顺序是 _________ (填相应的离子符号)。
(2) 由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,写出该反应的化学反应方程式________________,若有19.2g铜参加反应则会生成标准状况下气体体积为________。
(3) 用电子式表示M2W的形成过程_____________________________________________
(4) 由M、Z两元素形成的原子个数比为1∶1化合物的电子式为__________________ ,化学键类型是__________________
(5) 由X、Y、Z、W四种元素组成的一种盐A,已知:①1molA能与足量NaOH浓溶液反应生成标准状况下22.4L气体。②A能与盐酸反应产生气体B,该气体能与溴水反应。写出A的化学式_______________________________,该气体B与溴水反应的离子方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(![]() )在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中正确的是
)在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中正确的是
A. 甲醛分子间可以形成氢键B. 甲醛分子和甲醇分子内C原子均采取sp2杂化。
C. 甲醛为极性分子D. 甲醇的沸点远低于甲醛的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在平衡:I2(aq)+I-(aq)![]() I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的平衡曲线图如下。下列说法不正确的是
I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的平衡曲线图如下。下列说法不正确的是
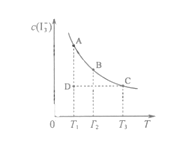
A.反应I2(aq)+I-(aq)![]() I3-(aq)的△H>0
I3-(aq)的△H>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态D时,一定有![]()
D.状态A与状态B相比,状态A的c (I2) 小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用不同的实验装置研究苯与液溴的反应并制取少量溴苯。试回答下列问题:


(1)若采用图甲装置进行实验,装置A中应预先需加入的试剂是____,E装置的作用是___。
(2)若采用图乙装置进行实验,C中盛放的CCl4的作用是____________。
(3)若使用图乙装置,实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,然后用___(填仪器名称)分离出溴苯(仍含有少量苯)。写出有关的离子反应方程式__________。
(4)反应完毕后,向试管D中滴加AgNO3溶液,若有_______(填现象)生成,说明这种获得溴苯的反应属于______ (填有机反应类型)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度时,将1 mol A和2 mol B放入容积为5 L的某密闭容器中发生反应A(s)+2B(g)![]() C(g)+2D(g),经5 min后,测得容器内B的浓度减少了0.2 mol/L。下列叙述中错误的是
C(g)+2D(g),经5 min后,测得容器内B的浓度减少了0.2 mol/L。下列叙述中错误的是
A. 在5 min内该反应用C的浓度变化表示的反应速率为0.02 mol/(Lmin)
B. 5 min时,容器内D的浓度为0.2 mol/L
C. 该可逆反应随着反应的进行,容器内压强逐渐增大
D. 5 min时,容器内气体总的物质的量为3 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com