
| A. | 不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4) | |
| B. | 抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替 | |
| C. | 若误饮c(Ba2+)=1.0×10-5 mol•L-1的溶液时,会引起钡离子中毒 | |
| D. | 可以用0.36 mol•L-1的Na2SO4溶液给钡离子中毒患者洗胃 |
分析 因胃酸可与CO32-反应生成水和二氧化碳,使CO32-浓度降低,从而使平衡BaCO3(s)?Ba2+(aq)+CO32-(aq) 向溶解方向移动,则BaCO3溶于胃酸,而硫酸钡不溶于酸,结合溶度积解答该题.
解答 解:A.因胃酸可与CO32-反应生成水和二氧化碳,使CO32-浓度降低,从而使平衡BaCO3(s)?Ba2+(aq)+CO32-(aq) 向溶解方向移动,使Ba2+浓度增大,Ba2+有毒,与Ksp大小无关,故A错误;
B.BaCO3溶于胃酸,起不到解毒的作用,故B错误;
C.c(Ba2+)=1.0×10-5 mol•L-1的溶液钡离子浓度很小,不会引起钡离子中毒,故C错误;
D.用0.36 mol•L-1的Na2SO4溶液给钡离子中毒患者洗胃,反应后c(Ba2+)=$\frac{1.1×1{0}^{-10}}{0.36}$mol/L,浓度很小,可起到解毒的作用,故D正确.
故选D.
点评 本题主要考查了溶度积的计算以及溶解平衡的判断及沉淀溶解平衡的应用,侧重于化学与生活的考查,为高频考点,有利于培养学生良好的科学素养,难度不大.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 通过加热分解HgO可制得单质Hg | |
| B. | 铝热法炼铁的还原剂是单质铝 | |
| C. | 高炉炼铁时,是还原剂CO将铁从铁矿石中还原出来 | |
| D. | 蔗糖、果糖和葡萄糖都可以发生水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LCCl4含有的分子数为NA | |
| B. | 常温常压下,18g水含有的分子数为 NA | |
| C. | 常温下,1mol Cl2与过量NaOH溶液反应,转移电子总数为2NA | |
| D. | 1L0.1 mol•L-1 Na2CO3溶液中含有CO32-数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
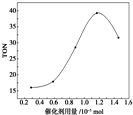 在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯:CO2+2CH3OH-→CO(OCH3)2+H2O.某研究小组在其他条件不变的情况下,通过研究催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果.计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量.根据该研究小组的实验及催化剂用量TON的影响图,判断下列说法不正确的是( )
在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯:CO2+2CH3OH-→CO(OCH3)2+H2O.某研究小组在其他条件不变的情况下,通过研究催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果.计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量.根据该研究小组的实验及催化剂用量TON的影响图,判断下列说法不正确的是( )| A. | 由甲醇和CO2直接合成碳酸二甲酯,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义 | |
| B. | 在反应体系中添加合适的吸水剂,将提高该反应的TON | |
| C. | 当催化剂用量为1.2×10-5 mol时,该反应的TON达到最高点 | |
| D. | 当催化剂用量高于1.2×10-5 mol时,随着催化剂用量的增加,甲醇的平衡转化率逐渐降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)>c(H+) | B. | c(CH3COOH)+c(CH3COO-)=0.2 mol•L-1 | ||
| C. | c(CH3COOH)>c(CH3COO- ) | D. | c(CH3COO- )+c(OH- )=0.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器中总压强不再随时间而变化 | |
| B. | v正(B)=0.03mol/(L•s),v逆(D)=1.2mol/(L•min) | |
| C. | 单位时间内断裂一个A-A键,同时生成两个C-C键 | |
| D. | 容器中混合气体的密度不再随时间而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
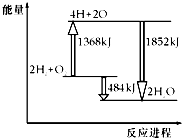 如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图,下列说法不正确的是( )
如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图,下列说法不正确的是( )| A. | 拆开2molH2(g)和1molO2(g)中的化学键成为H、O原子,共吸收1368kJ能量 | |
| B. | 由H、O原子形成2molH2O(g),共放出1852kJ能量 | |
| C. | 2molH2(g)和1molO2(g)反应生成2molH2O(g),共吸收484kJ能量 | |
| D. | 2molH2(g)和1molO2(g)反应生成2molH2O(g),共放出484kJ能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com