
| 实验操作 | 实验现象及结论 |
| ①取粗产品于试管中,加入1.0 mol•L-1Na2CO3溶液,酯溶解度减小振荡分层,用分液漏斗分液,得到水层加入0.1 mol•L-1BaCl2溶液 | 白色沉淀生成,说明含有硫酸 |
| ②取①反应后的溶液于试管中,加入1 mol•L-1HCl溶液 | 出现白色晶体,证明含有苯甲酸 |
分析 检验方法为:可以取少量于试管中,加入碳酸钠溶液,降低甲酸甲酯溶解度,苯甲酸和硫酸全部反应生成苯甲酸钠和硫酸钠溶液,分液漏斗分液后得到苯甲酸钠和硫酸钠溶液,加入氯化钡溶液,出现白色沉淀硫酸钡,证明含有硫酸,再取少量上述反应后的溶液,加入盐酸生成白色晶体,证明含有苯甲酸.
解答 解:某甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸、和水等,某同学为了检验产品中的苯甲酸和硫酸,可以取少量于试管中,加入碳酸钠溶液,降低甲酸甲酯溶解度,苯甲酸和硫酸全部反应生成苯甲酸钠和硫酸钠溶液,分液漏斗分液后得到苯甲酸钠和硫酸钠溶液,加入氯化钡溶液,出现白色沉淀硫酸钡,证明含有硫酸,再取少量上述反应后的溶液,加入盐酸生成白色晶体,证明含有苯甲酸;
故答案为:
| 实验操作 | 实验现象及结论 |
| ①取粗产品于试管中,加入1.0 mol•L-1Na2CO3溶液,酯溶解度减小振荡分层,用分液漏斗分液,得到水层加入0.1 mol•L-1BaCl2溶液 | 白色沉淀生成,说明含有硫酸 |
| ②取①反应后的溶液于试管中,加入1 mol•L-1HCl溶液 | 出现白色晶体,证明含有苯甲酸 |
点评 本题考查了物质检验的实验分析应用,主要是实验现象和结论的分析判断,掌握物质性质是解题关键,题目难度中等.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 由Cl2+H2O=HCl+HClO可推出F2+H2O=HF+HFO | |
| B. | HCl的水溶液是强酸,推出HF水溶液也是强酸 | |
| C. | 由2Fe+3Cl2=2FeCl3可推出2Fe+3I2=2FeI3 | |
| D. | Na、K在属于同一主族,化学性质相似,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
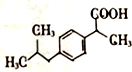
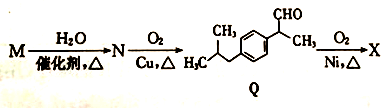
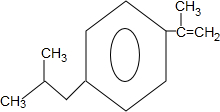 +H2O$→_{△}^{催化剂}$
+H2O$→_{△}^{催化剂}$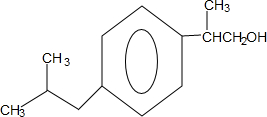 .
. 或
或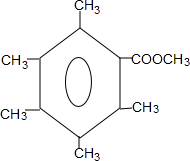 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )
浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )| A. | 实验开始时需给a试管稍微加热 | |
| B. | 反应开始时铜片表面可以看到有黑色物质生成 | |
| C. | 将a试管里的溶液冷却后注入盛有水的烧杯中,溶液呈蓝色 | |
| D. | b试管中的溶液逐渐褪为无色,说明反应生成的气体,将品红氧化为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
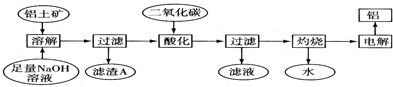
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
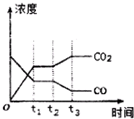 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.| H2O | CO | CO2 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
| 容器编号 | c(CO)/mol•L-1 | c(O2))/mol•L-1 | c(CO2))/mol•L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | 溶液变(血)红色 | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入1~2滴③或④(填序号)溶液,振荡 | 紫红色褪去或产生蓝色沉淀 | 存在Fe2+ |
| 实验编号 | 操 作 | 现 象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
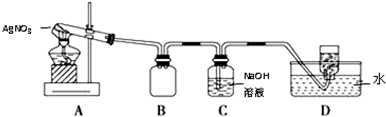
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com