
| A. | NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ | B. | NH3+CO2+H2O═NH4HCO3 | ||
| C. | 2NaBr+Cl2═2NaCl+Br2 | D. | CuSO4+Fe═Cu+FeSO4 |
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | Al | B. | Al(OH)3 | C. | AlCl3 | D. | Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、NO2、粉尘、煤烟 | B. | CO2、O2、氮的氧化物、碳氢化合物 | ||
| C. | Cl2、N2、煤烟、氮的氧化物 | D. | H2S、SO2、粉尘、煤烟、氮的氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
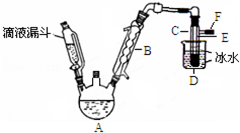 如图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置.有关数据见表:
如图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置.有关数据见表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
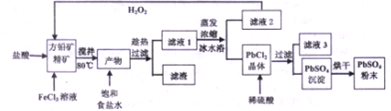
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
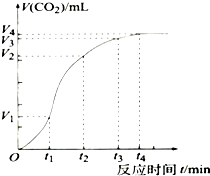 为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线(图).请分析讨论以下问题.
为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线(图).请分析讨论以下问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
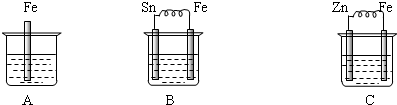
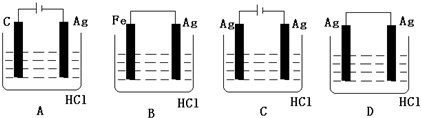
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CHBr属于卤代烃 | |
| B. | 卤代烃密度都大于水 | |
| C. | 卤代烃都会水解生成醇 | |
| D. | 卤代烃都能和NaOH醇溶液发生消去反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com