
| A. | 标准状况下,22.4L四氯化碳的分子数约为NA个 | |
| B. | 将含1molFeCl3的饱和溶液制成胶体,最后得到NA个Fe(OH)3胶粒 | |
| C. | 6.5gZn与足量HNO3反应,转移0.2NA个电子 | |
| D. | 在1L的碳酸钠溶液中,若c(CO32-)=1mol•L-1,则Na+个数为2NA |
分析 A.标准状况下,四氯化碳的状态不是气体;
B.氢氧化铁胶粒为氢氧化铁的聚集体,无法计算氢氧化铁胶粒的数目;
C.6.5g锌的物质的量为0.1mol,0.1mol锌与足量硝酸反应后生成0.1mol锌离子,失去0.2mol电子;
D.碳酸根离子部分水解,则钠离子的浓度大于2c(CO32-).
解答 解:A.标准状况下,四氯化碳不是气体,不能使用标准状况下的气体摩尔体积计算四氯化碳的物质的量,故A错误;
B.将含1molFeCl3的饱和溶液制成胶体,由于氢氧化铁胶粒为氢氧化铁的聚集体,则最后得到的Fe(OH)3胶粒数目小于NA,故B错误;
C.6.5gZn的物质的量为:$\frac{6.5g}{65g/mol}$=0.1mol,0.1molZn与足量HNO3反应生成0.1mol锌离子,转移0.2mol电子,转移0.2NA个电子,故C正确;
D.1L的碳酸钠溶液中,若c(CO32-)=1mol•L-1,由于碳酸根离子部分水解,则c(Na+)>2c(CO32-)=2mol/L,1L该溶液中含有的钠离子的物质的量大于2mol,则Na+个数大于2NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的计算与判断,题目难度中等,明确物质的量与阿伏伽德罗常数、摩尔质量、物质的量浓度的关系为解答关键,B为易错点,注意氢氧化铁胶粒为氢氧化铁的聚集体.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A. | 反应在0~t1min内的平均速率为v(SO3)=0.088/t1mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.10molSO3和0.010molO2,到达平衡时,n(SO2)=0.012mol | |
| C. | 保持其他条件不变,升高温度,平衡时c(SO2)=0.0070mol•L-1,则反应的△H>0 | |
| D. | 相同温度下,起始时向容器中充入0.050molSO2和0.030molO2,达到平衡时SO2转化率大于88% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
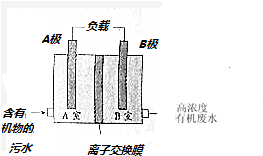
| A. | A极上发生类似C6H10O5-24e+7H2O═6CO2↑+24H+的电极反应 | |
| B. | B极上发生的是还原反应,工作过程中电极周围溶液的pH增大 | |
| C. | 工作过程中外电路的电子由A极流向B极,溶液中则由B极流向A极 | |
| D. | 污水中所存在的阳离子经离子交换膜由A室流向B室. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu、CuSO4、正极 | B. | Cu、CuCl2、负极 | C. | CuCl2、Cu、正极 | D. | Cu、CuSO4、负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 向电解质溶液中加入新物质时,其导电性符合如图所示变化趋势的实验操作是②.
向电解质溶液中加入新物质时,其导电性符合如图所示变化趋势的实验操作是②.查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
碳酸铵[(NH4)2C03]在室温下就能自发地分解产生氨气,对其说法中正确的是( )
A.碳酸铵分解主要是因为生成了易挥发的气体,使体系的熵增大
B.碳酸铵分解主要是因为外界给予了能量
C.碳酸铵分解是吸热反应,可根据焓变判断碳铵不能自发分解
D.碳酸盐都不稳定,都能自发分解
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
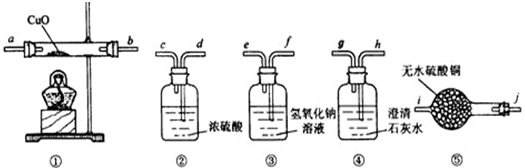
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol/L | B. | 0.01 mol/L | C. | 0.1 mol/L | D. | 0.02 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br2 | B. | I2和 KCl | C. | I2.KCl和NaCl | D. | KCl和NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com