


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
| A、二氧化硫、二氧化氮、氮气 |
| B、二氧化硫、二氧化氮、一氧化碳 |
| C、二氧化硫、一氧化碳、二氧化碳 |
| D、二氧化氮、一氧化碳、水蒸气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
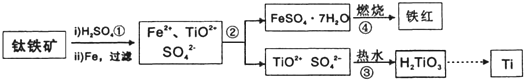
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、K+、CO32-、NO3- |
| B、OH-、Cl-、Na+、NH4+ |
| C、Mg2+、K+、Cl-、NO3- |
| D、Cu2+、NO3-、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=2的HA酸溶液与pH=12的MOH碱溶液以任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) | ||||||||||
| B、对于0.1mol/LNa2SO3溶液:c(Na+)=2c(SO32-)+c(HSO3-)+2c(H2SO3) | ||||||||||
C、等浓度、等体枳的Na2CO3和NaHCO3混合:
| ||||||||||
| D、将足量AgCl分别放入:①5m水,②10mL0.2mol/LMgC12,③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、②③ |
| C、③④ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、白色污染是指聚乙烯、聚氯乙烯等塑料垃圾 |
| B、吗啡、海洛因等虽有麻醉、止痛、镇静作用,但易上瘾且有害,这类物质属于毒品 |
| C、使用青霉素时,直接静脉注射即可 |
| D、青霉素对病原体有抑制和杀灭作用,是“治本”;阿司匹林解热镇痛是“治标” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com