
【题目】碳酸钡是一种重要的无机盐产品,广泛应用于工业陶瓷、光学玻璃、建筑等行业。碳化法生产碳酸钡的工艺流程示意图如下:
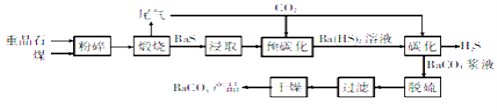
已知:重晶石的主要成分是BaSO4;Ba(HS)2溶液呈弱碱性;2BaS+2H2O=Ba(OH)2+Ba(HS)2。
回答下列问题:
(1)煅烧时发生反应的化学方程式为 ,该反应的氧化产物的电子式为 ;当温度过高时,尾气中有毒气体的含量会升高,原因是 (用化学方程式表示)。
(2)为了提高浸取速率,可采取的措施是 (任写一种)。
(3)碳化时发生反应的离子方程式为 。
(4)脱硫过程是用Na2CO3溶液将BaCO3浆液中含有的BaS2O3除去:CO32-+BaS2O3=BaCO3+S2O32-,该反应的平衡常数为 【已知Ksp(BaCO3)=2.5×10-9,Ksp(BaS2O3)=1.6×10-5】。
(5)Ba(HS)2溶液中离子浓度由大到小的顺序为 。
(6)BaCO3不能用于医疗用的“钡餐”,原因是 。
【答案】(13分)(1)BaSO4+2C![]() BaS+2CO2↑;(2分)
BaS+2CO2↑;(2分)
![]() (1分);CO2+C
(1分);CO2+C![]() 2CO;(2分)
2CO;(2分)
(2)适当提高温度(或搅拌等);(1分)
(3)CO2+H2O+Ba2++2HS-=BaCO3↓+2H2S↑;(2分)
(4)6.4×103;(2分)
(5)c(HS-)>c(Ba2+)>c(OH-)>c(H+)>c(S2-);(2分)
(6)BaCO3 与胃酸中的盐酸反应生成可溶性的重金属盐BaCl2,会使人中毒;(1分)
【解析】
试题分析:(1)碳酸钡粉碎后煅烧和碳反应生成硫化钡和二氧化碳,反应的化学方程式为:BaSO4+2C![]() BaS+2CO2↑,反应中碳元素化合价升高失电子做还原剂被氧化得到氧化产物二氧化碳,二氧化碳中存在两个碳氧双键,属于共价化合物,电子式为:
BaS+2CO2↑,反应中碳元素化合价升高失电子做还原剂被氧化得到氧化产物二氧化碳,二氧化碳中存在两个碳氧双键,属于共价化合物,电子式为:![]() ;温度过度时CO2+C
;温度过度时CO2+C![]() 2CO,尾气中有毒气体的含量会升高;
2CO,尾气中有毒气体的含量会升高;
(2)提高浸取速率可以升温、搅拌、粉碎增大接触面积等措施;
(3)碳化时Ba(HS)2和H2S气体粉碎反应生成碳酸钡沉淀和硫化氢气体,反应的离子方程式为:CO2+H2O+Ba2++2HS-=BaCO3↓+H2S↑;
(4)CO32-+BaS2O3═BaCO3+S2O32-,该反应的平衡常数
K=![]() =
=![]() =6.4×103;
=6.4×103;
(5)Ba(HS)2溶液中溶质是强碱弱酸盐,HS-离子水解程度大于其电离程度溶液显碱性,溶液中离子浓度大小为:c(HS-)>c(Ba2+)>c(OH-)>c(H+)>c(S2-)。
(6)碳酸钡与稀盐酸反应生成氯化钡、水和二氧化碳,该反应的化学方程式为:BaCO3+2HCl=BaCl2+CO2↑+H2O,BaCO3与胃酸中的盐酸反应生成可溶性的重金属盐氯化钡会使人中毒。


科目:高中化学 来源: 题型:
【题目】将CO2转化为甲醇的原理为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH <0。500 ℃时,在体积为1 L 的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是( )
CH3OH(g)+H2O(g) ΔH <0。500 ℃时,在体积为1 L 的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是( )

A.曲线X可以表示CH3OH(g)或H2O(g)的浓度变化
B.从反应开始到10min时,H2的反应速率υ(H2)=0.225 mol/(L·min)
C.平衡时H2 的转化率为75%
D.500 ℃时该反应的平衡常数K=3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素的原子序数依次增大。A和C,B和E同主族,C、D、E同周期。由A、B组成的两种化合物甲和乙都为液态,甲中A、B原子数之比为2:1,乙中为1:1。由B、C组成的两种化合物丙和丁都为固态,丙中C、B原子数之比为2:1,丁中为1:1。C、D、E的最高价氧化物对应的水化物两两之间均能发生反应,且均有甲生成,且A为原子半径最小的短周期元素,丁为淡黄色固体。则:
(1)D的原子结构示意图为:__________________
(2)A元素的单质为:_____________(填化学式);丁的电子式为:_____________
(3)E在周期表中的位置_________________________________
(4)C、D的最高价氧化物对应水化物发生反应的离子方程式为:
____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
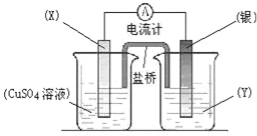
(1)电极X的材料是 (化学式);电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表得第_____________族,其基态原子中未成对电子的个数为______。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为____________________,所含非金属元素的电负性由大到小的顺序是____________________。
(3)尿素分子中、碳原子为________杂化,分子中σ键与π键的数目之比为____________________。
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需要知道的数据是______。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为____________________。
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如下图所示,则该物质的化学式为____________________。若晶体密度为dg·cm3,则晶胞中最近的两个碳原子的距离为____________________pm(阿伏伽德罗常数的值用NA表示,写出简化后的计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应A(g)+3B(s) ![]() 2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
A. v(A)=0.5 mol·L-1·min-1 B. v(B)=1.2 mol·L-1·s-1
C. v(C)=0.1 mol·L-1·s-1 D. v(D)=0.4 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰元素广泛分布在自然界中,其单质和化合物在工农业生产中有着重要的应用。
(1)已知相关热化学方程式为:
4Al(s)+3O2(g)=2Al2O2(s) △H1=a kJmol﹣1
3MnO2(s)=Mn3O4(s)+O2(g) △H2=bkJmol﹣1
3Mn3O4(s)+8Al(s)=9Mn(s)+4Al2O3(s) △H3=ckJmol﹣1
则3MnO2(s)+4Al(s)=3Mn(s)+2Al2O3(s) △H=__ kJmol﹣1(用含a、b、c的代数式表示).
(2)MnCO3广泛用作锰盐原料.通过如图装置焙烧MnCO3可以制取MnO2,反应方程式为:2MnCO3(s)+O2(g)═2MnO2(s)+2CO2(g)。
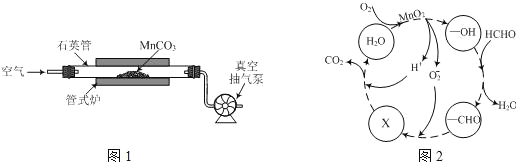
①2MnCO3(s)+O2(g)2MnO2(s)+2CO2(g)的化学平衡常数表达式K=______。
②用真空抽气泵不断抽气的目的除保证反应持续进行外,还有______。
③若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________(填序号)。(如图中V正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
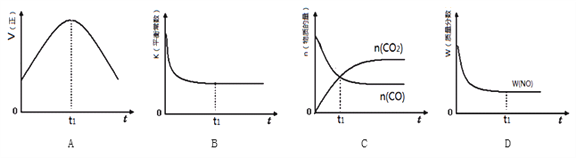
(3)MnO2常用作催化剂。MnO2催化降解甲醛的反应机理如图所示,图中X表示的粒子是______,该反应的总反应方程式为______。
(4)MnSO4是重要微量元素肥料。用惰性电极电解MnSO4溶液可以制得更好活性的MnO2,电解时总反应的离子方程式为:______,电解过程中阴极附近的pH______(选填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性的无色溶液中能大量共存的离子组是( )
A.NH4+、Mg2+、SO42﹣、Cl﹣ B.Ba2+、K+、OH﹣、NO3﹣
C.Al3+、Cu2+、SO42﹣、Cl﹣ D.Na+、Ca2+、Cl﹣、HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制0.1molL﹣1NaCl溶液,下列操作会导致所配溶液的物质的量浓度偏高的是( )
A.称量时,左盘低,右盘高 B.定容时俯视读取刻度
C.原容量瓶洗净后未干燥 D.定容时液面超过了刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com