
F1 F2 F3 G4 H3【2014·宁夏银川一中三模】(14分)
运用化学反应原理知识回答下列有关碳和碳的化合物的问题:
(1)汽车尾气的主要污染物是NO以及燃料燃烧不完全所产生的CO,它们是现代化城市的重要大气污染物,为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应△H<0). 在2 L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|
T/℃ n/mol | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |
①请结合上表数据,写出NO与CO反应的化学方程式 .
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,根据表中数据计算K1= 。根据表中数据判断,温度T1和T2的关系是(填序号)__________。
A.T1>T2B.T1<T2 C.T1=T2 D.无法比较
(2)反应生成的气体E经常用氢氧化钠来吸收,现有0.4molE,若用200mL 3mol/L NaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: .
(3)已知CH4、H2和CO的燃烧热分别为890.3kJ/mol,285.8 kJ/mol和283.0 kJ/mol,工业上利用天然气(主要成分是CH4)与CO2进行高温重整制备CO和H2,写出该反应的热化学方程式: .
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用 Li2CO3 和 Na2CO3 的熔融盐混合物作电解质,CO为负极燃气,空气与CO2 的混合气为正极助燃气,制得在 650 ℃下工作的燃料电池,写出其负极和正极电极反应方程式:负极: ;正极: .
【知识点】化学平衡移动、计算、热化学方程式书写、盖斯定律、电极反应式的书写
 【答案解析】 (1)①2CO+2NO N2+2CO2(2分)
【答案解析】 (1)①2CO+2NO N2+2CO2(2分)
②3200 L/mol(或3200)(2分) A(2分)
⑵C(Na+)>C(HCO3-)>C(CO32-)>C(OH -)>C(H+)(2分)
(3) CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247.3 kJ•mol -1(2分)
⑷2CO+2CO32--4e-=4CO2(2分)O2+2CO2+4e-=2CO32-(2分)
解析:(1)①NO和CO在一定条件下转化为两种无毒气体E和F,是氮气和二氧化碳,反
 应的方程式为2CO+2NO N2+2CO2;通过平衡时各物质的物质的
应的方程式为2CO+2NO N2+2CO2;通过平衡时各物质的物质的
 量也验证这一反应;②利用“三段式”进行计算:2CO + 2NO N2 + 2CO2
量也验证这一反应;②利用“三段式”进行计算:2CO + 2NO N2 + 2CO2
始态浓度(mol/L)0.05 0.05 0 0
变化量(mol/L) 0.04 0.04 0.02 0.04
平衡浓度(mol/L) 0.01 0.01 0.02 0.04
则K=C(N2)·C2(CO2)/ C2(CO)·C2(NO)=3200 L/mol;
该反应放热,从表中看出,从T1到T2,平衡正向移动,降低温度,故A.T1>T2;
(2)气体E是CO2,0.4mol CO2,用200mL 3mol/L NaOH溶液(物质的量是0.6mol)将其完全吸收,产物生成0.2molNa2CO3和0.2molNaHCO3,CO32-和HCO3-要水解使溶液呈碱性,前者的水解程度远大于后者,所以离子浓度大小:
C(Na+)>C(HCO3-)>C(CO32-)>C(OH -)>C(H+)
(3) 根据CH4、H2、和CO的燃烧热可知,各物质燃烧的热化学方程式:
①O2(g)+2H2(g)=2H2O(L)△H=-571.6kJ•mol -1;
②CH4(g)+2O2(g)=CO2(g)+2H2O(L)△H=-890.3kJ•mol-1;
③2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1,
利用盖斯定律将②-①-③可得:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.3 kJ•mol -1;
(4)在燃料池中,正极上是CO2发生失去电子的氧化反应,电极反应为:O2+2CO2+4e-=2CO32-,负极上是CO发生失电子的氧化反应,反应式:2CO+2CO32--4e-=4CO2,在转移电子一样多的情况下,两极反应相加得到总反应:2CO+O2=2CO2;
【思路点拨】本题考查比较综合,可逆反应平衡常数的简单计算方法,盖斯定律的应用。注意书写热化学方程式的要领;电极反应式的书写要看电解质中的离子存在形式。难度中等。


科目:高中化学 来源: 题型:
Ⅰ、已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反
应的体系中共有KCl.Cl2.H2SO4.H2O.KMnO4.MnSO4.K2SO4七种物质:
(1)该反应中,化合价升高的反应物是 。
(2)写出一个包含上述七种物质的氧化还原反应方程式:
(3)上述反应中,氧化剂是 ,1 mol氧化剂在反应中得到 mol电子。
Ⅱ、某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数测定
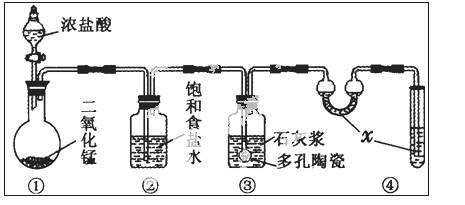
(1)装置④中的x试剂为 。
(2)装置③中发生反应的化学方程式为 。该反应是放热反应,反应温度较高时有副反应发生。改进该实验装置以减少副反应发生的方法是 _______________。
(3)测定漂白粉有效成分的质量分数
称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.1000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:
3ClO-+ I- = 3Cl-+ IO3- IO3- + 5I- + 3H2O = 6OH- + 3I2
实验测得数据如下表所示。
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为 。若滴定过程中未充分振荡溶液局部变浅蓝色时就停止滴定,则测定结果将 (填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
硒(Se)被科学家称之为人体微量元素中的“防癌之王”,同时也是“心脏的守护神”“肝病的天敌”,对人体具有良好的保健作用。已知硒为第四周期、与氧同一族,根据它在周期表中的位置推测,硒不可能具有的性质为( )
A.硒也有两种氧化物,分别为SeO2和SeO3两种
B.硒化氢属于共价化合物,比硫化氢稳定
C.硒化氢的水溶液显弱酸性
D.硒单质的非金属性比氧弱
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期A、B、C、D 、E 5种元素,原子序数依次增大,A为周期表中的原子半径最小的元素,B原子的最外层上有4个电子;C与A可形成含有3个原子、10个电子的分子;C的阴离子和D+ 的阳离子具有相同的电子层结构;E的L层电子数等于K、M两个电子层上电子数之和。
(1)下列元素的符号:A为 C为 D
(2) 用电子式表示D、E两元素形成化合物的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2、NO是大气污染物。吸收SO2 和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
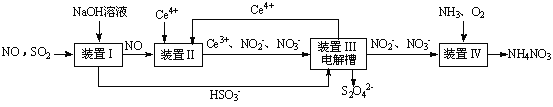
(1)装置Ⅰ中生成HSO3-的离子方程为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如右图所示。
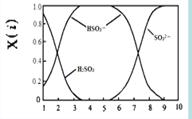
①下列说法正确的是 (填字母序号)。
a.pH=8时,溶液中c(HSO3-) < c(SO32-)
b.pH=7时,溶液中c(Na+) =c(HSO3-)+c(SO32-)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
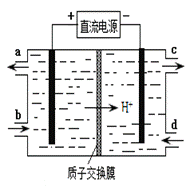
①生成Ce4+的电极反应式为 。
②生成Ce4+从电解槽的 (填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用酸溶解去除
B.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进了Fe3+水解
C.向纯水中加入盐酸或降温都能使水的离子积减小,电离平衡逆向移动
D.反应2A(g) + B(g)=3C (s) + D(g)在一定条件下能自发进行,说明该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
以乙炔或苯为原料可合成有机酸H2MA,并进一步合成高分子化合物PMLA。
I.用乙炔等合成烃C。
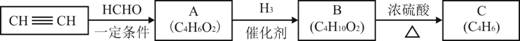
已知:

(1)A分子中的官能团名称是_______、_______。
(2)A的一种同分异构体属于乙酸酯,其结构简式是________________
(3)B转化为C的化学方程式是________________________________________,其反应类型是_______。
II.用烃C或苯合成PMLA的路线如下。
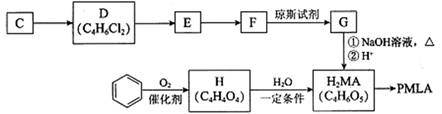
已知:

(4)1 mol有机物H与足量NaHCO3溶液反应生成标准状况下的CO2 44.8 L,H有顺反异构,其反式结构简式是________________
(5)E的结构简式是________________
(6)G与NaOH溶液在加热条件下反应的化学方程式是_________________________
(7)聚酯PMLA有多种结构,写出由H2MA制PMLA的化学方程式(任写一种)________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
下列同组中的两种物质,属于官能团异构的是( )
A、CH3CH2CH2OH和 CH3CH(OH)CH3
B、CH3 CH( CH3)2和 CH3 CH2CH2 CH3
C、CH3CH2OH和 CH3OCH3
D、CH2=CHCH2CH2CH3和CH3CH2CH = CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图所示装置为在直流电的作用下电解CuSO4 溶液图,其中A、B为石墨电极,
a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则:
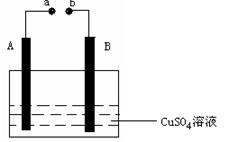 (1) a为电源的 极。
(1) a为电源的 极。
b为电源的 极
(2) 写出电极反应方程式:
A ,
B 。
(3)A电极析出气体体积为 L(在标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com