
A、B是两个完全相同的装置,如下图所示,某学生分别在A、B的侧管中装入1.06 g Na2CO3和0.84 g NaHCO3,A、B中分别装有10 mL相同浓度的盐酸,将两个侧管中的物质同 时倒入各自的试管中,下列叙述正确的是
时倒入各自的试管中,下列叙述正确的是
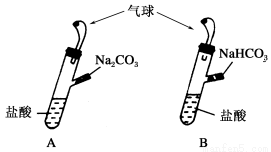
A.A装置的气球膨胀得快
B.若最终两气球体积相同,则盐 酸的浓度一定大于或等于2 mol·L-1
酸的浓度一定大于或等于2 mol·L-1
C.若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol·L-1
D.最终两试管中Na+、Cl-的物质的量一定相同
科目:高中化学 来源:2017届西藏拉萨中学高三上期末理综化学卷(解析版) 题型:选择题
在可逆反应2SO2+O2 2SO3的平衡状态下,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是(K为平衡常数,QC为浓度商)
2SO3的平衡状态下,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是(K为平衡常数,QC为浓度商)
A.QC不变,K变大,O2转化率增大
B.QC变小,K不变,O2转化率减小
C.QC不变,K变大,SO2转化率增大
D.QC增大,K不变,SO2转化率增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高二上月考二化学卷(解析版) 题型:选择题
A、B、C都是有机化合物,且有如下转化关系:A B
B C,A的相对分子质量比B大2,C的相对分子质量比B大16,C能与氢氧化钠反应,以下说法正确的是( )
C,A的相对分子质量比B大2,C的相对分子质量比B大16,C能与氢氧化钠反应,以下说法正确的是( )
A.A是乙炔,B是乙烯 B.A是乙烯,B是乙烷
C.A是乙醇,B是乙醛 D.A是环己烷,B是苯
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林长春外国语学校高一上月考二化学卷(解析版) 题型:选择题
在下列溶液中,各组离子一定能够大量共存的是
A.使酚酞试液变红的溶液:Na+、Cl-、SO 、Fe3+
、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、MnO 、Cl-
、Cl-
C.pH<7的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO 、Cl-、H+
、Cl-、H+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林长春外国语学校高一上月考二化学卷(解析版) 题型:选择题
海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用以达到富集的目的,化学反应为Br2+SO2+2H2O=2HBr+H2SO4,下列说法正确的是
A.Br2在反应中表现氧化性 B.SO2在反应中被还原
C.Br2在反应中失去电子 D.1 mol氧化剂在反应中得到1 mol电子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高一12月月考化学试卷(解析版) 题型:实验题
一种新型高效净水剂PAFC(聚合氯化铁铝[AlFe(OH)nC16-n]m),广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取PAFC,设计生产流程如下:
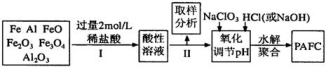
请回答下列问题:
(1)用l0 mol/L的浓盐酸配制2mol/L的稀盐酸,所用玻璃仪器除量筒和玻璃棒外,还有 。
A.容量瓶 B.烧杯 C.烧瓶 D.胶头滴管
(2)下列关于PAFC的说法中正确的有( )
A.PAFC是一种无机高分子化合物
B.PAFC中Fe显+2价
C.PAFC溶于水电离出OH—,是碱
D.PAFC在强酸性和强碱性溶液中均不能稳定存 在
在
(3)步骤Ⅱ中取样分析的目的是( )
A.测定溶液中Fe2+与Fe3+的含量比
B.测定原料是否完全溶解
C.测定溶液中Fe2+的含量,以确定加入NaClO3的量
D.测定溶液中Al3+的含量
(4)写出向溶液中加入NaClO3时,发生反应的离子方程式为______________________。
(5)该化工厂的化验室为测定产品PAFC中A1和Fe的含量,进行下列试剂的选择和基本操作:测定时所需的试剂有_______________。
A.NH3·H2O B.NaOH C.CO2 D .NaClO3
.NaClO3
(6)在测定过程中的操作顺序是: 过滤、___________、灼烧、_________、称量。(写操作名称)。
(7)测定时,直接称量的是____________和_____________的质量(填化学式)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高一12月月考化学试卷(解析版) 题型:选择题
将Cu片放入0.1 mol·L-1FeCl3溶液中,反应一定时间后取出Cu片,所得溶液Q中的c(Fe3+):c(Fe2+)=2:3,下列有关说法中正确的是
A.Q中n(Cu2+):n(Fe2+)=1:2
B.反应中转移电子为0.04 mol
C.溶液Q比原溶液增重了 1.28 g
D.3c(Fe3+)+ 2c(Fe2+)+ 2c(Cu2+)=0.1 mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二12月月考化学试卷(解析版) 题型:填空题
工业废水中常含有一定量的Cr2O72﹣和CrO42﹣,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为CrO42﹣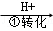 Cr2O72﹣
Cr2O72﹣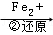 Cr3+
Cr3+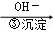 Cr(OH)3↓ 其中第①步存在平衡:2CrO42﹣(黄色)+2H+
Cr(OH)3↓ 其中第①步存在平衡:2CrO42﹣(黄色)+2H+ Cr2O72﹣(橙色)+H2O
Cr2O72﹣(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。(选填编号)
a.Cr2O72﹣和CrO42﹣的浓度相同 b.v正(Cr2O72﹣)=2v逆(CrO42﹣)
c.溶液的颜色不变 d.溶液的pH值不变
(3)写出第②步中Cr2O72﹣转变为Cr3+的离子方程式: .
(4)向Cr2(SO4)3溶液中,滴加NaOH,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的[Cr(OH)4]﹣离子.其平衡关系如下:H++[Cr(OH)4]﹣(亮绿色) Cr(OH)3(s,灰绿色)+H2O
Cr(OH)3(s,灰绿色)+H2O  Cr3+(紫色)+H2O +3OH﹣.现向0.05mol·L﹣1的Cr2(SO4)3溶液50mL中,加入等体积0.6mol·L﹣1的NaOH溶液,充分反应后,溶液中可观察到的现象为 。
Cr3+(紫色)+H2O +3OH﹣.现向0.05mol·L﹣1的Cr2(SO4)3溶液50mL中,加入等体积0.6mol·L﹣1的NaOH溶液,充分反应后,溶液中可观察到的现象为 。
(5)在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以 形式存在(填写离子符号)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上期末化学试卷(解析版) 题型:填空题
电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
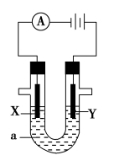
(1)若X、Y都是惰性电极,a是AgNO3溶液,实验开始时,同时在两边各滴入几滴石蕊试液,则
①电解池中Y电极上的电极反应式为 。在Y电极附近观察到的实验现象是 ;检验该电极反应产物的方法是 。
②X电极上的电极反应式为 。
(2)如要用电解方法精炼粗镍,电解液a选用Ni(NO3)2溶液,则:
①X电极的材料是 ,电极反应式为 ;
②Y极的材料是 ,电极反应式为  。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com