
| A. | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液,溶液呈血红色 | |
| B. | 在溶液中加入K3[Fe(CN)6]溶液,生成蓝色沉淀,证明原溶液中有Fe2+ | |
| C. | 向FeCl3溶液中滴加稀氨水,可制备Fe(OH)3胶体 | |
| D. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{蒸发、灼烧}{→}$无水FeCl3 |
分析 A.将稀硝酸加入过量铁粉中,生成硝酸亚铁;
B.Fe2+与K3[Fe(CN)6]反应生成蓝色沉淀;
C.向FeCl3溶液中滴加稀氨水,生成氢氧化铁沉淀;
D.FeCl3易水解.
解答 解:A.将稀硝酸加入过量铁粉中,生成硝酸亚铁,加入KSCN溶液,溶液不变色,故A错误;
B.Fe2+与K3[Fe(CN)6]反应生成蓝色沉淀,可用于检验,故B正确;
C.向FeCl3溶液中滴加稀氨水,生成氢氧化铁沉淀,制备氢氧化铁胶体,应在沸水中滴加饱和氯化铁溶液,故C错误;
D.FeCl3易水解,生成盐酸易挥发,同时生成氢氧化铁,灼烧生成氧化铁,故D错误.
故选B.
点评 本题综合考查铁及及其化合物的性质与应用,为高频考点,侧重考查学生的分析能力以及元素化合物知识的综合理解和运用,难度不大,注意把握水解以及离子的检验方法.


科目:高中化学 来源: 题型:实验题
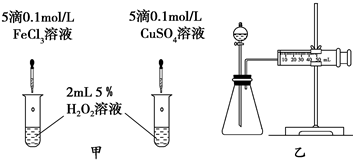
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | x+y<z | ||
| C. | B的转化率升 | D. | C的体积分数下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
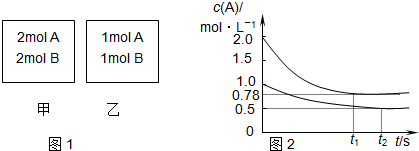
| A. | x=1 | |
| B. | 将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同 | |
| C. | 若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中:0.78 mol•L-1<c(A)<1.56 mol•L-1 | |
| D. | 若甲容器为等压可变容器,向甲中充入惰性气体,则c(A)减小,平衡正向移动,v(正)、v(逆)减 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
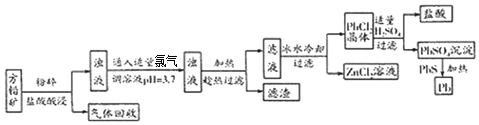
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5 mol NO2与足量的H2O反应,转移的电子数为NA | |
| B. | 常温常压下,0.5NA个CO2分子质量为22 g | |
| C. | 1 mol/L的CH3COOH中CH3COO-的浓度小于1 mol/L,而1 mol/L CH3COONa中CH3COO-等于1 mol/L | |
| D. | 18g 18O2中含有的中子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | K+ | Na+ | Cu2+ | Al3+ |
| 阴离子 | SO42- | HCO3- | NO3- | OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com