
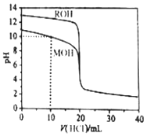
【题目】常温下,用浓度为![]() 的盐酸分别逐滴加入到
的盐酸分别逐滴加入到![]() 的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示.下列说法正确的是
的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示.下列说法正确的是![]()
A.![]() 时,溶液中微粒浓度的关系是:
时,溶液中微粒浓度的关系是:![]()
B.将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,溶液中离子浓度的关系是:![]()
C.![]() 时,溶液中微粒浓度的关系是:
时,溶液中微粒浓度的关系是:![]()
D.![]() 时,不可能存在:
时,不可能存在:![]()
【答案】B
【解析】
根据图知,未加HCl溶液时,ROH的![]() ,说明
,说明![]() ,为强碱;MOH的pH小于13,则MOH为弱碱;
,为强碱;MOH的pH小于13,则MOH为弱碱;
A.![]() 时,MOH溶液中加入10mLHCl溶液,溶液中的溶质为等物质的量浓度的MOH和MCl,溶液呈碱性,说明MOH电离程度大于MCl水解程度,MOH电离程度较小,氯离子不电离也不水解,所以
时,MOH溶液中加入10mLHCl溶液,溶液中的溶质为等物质的量浓度的MOH和MCl,溶液呈碱性,说明MOH电离程度大于MCl水解程度,MOH电离程度较小,氯离子不电离也不水解,所以![]() ,故A错误;
,故A错误;
B.将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,ROH已经完全反应,溶液中溶质为等物质的量浓度的MCl、RCl,MCl为强酸弱碱盐,![]() 水解导致溶液呈酸性,但水解程度较小,
水解导致溶液呈酸性,但水解程度较小,![]() 不水解,所以存在
不水解,所以存在![]() ,故B正确;
,故B正确;
C.![]() 时,溶液中溶质为MOH和MCl,且
时,溶液中溶质为MOH和MCl,且![]() ,溶液中存在物料守恒
,溶液中存在物料守恒![]() ,故C错误;
,故C错误;
D.![]() 时,HCl过量导致溶液呈酸性,根据电荷守恒得
时,HCl过量导致溶液呈酸性,根据电荷守恒得![]() ,溶液中溶质存在有
,溶液中溶质存在有![]() 、
、![]() 或
或![]() 三种情况,可能出现
三种情况,可能出现![]() ,故D错误;
,故D错误;
故选:B。


科目:高中化学 来源: 题型:
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:反应AX3(g)+X2(g)![]() AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。

(1)列式计算实验a从反应开始至达到平衡时的反应速率 v(AX5)=________________。
(2)图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为_______________(填实验序号);与实验a相比,其他两组改变的实验条件是:b_________________、c____________________________________。
(3)用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为_________________;实验a和c的平衡转化率:αa为___________、αc为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下氯化铁为棕黑色固体,易升华。实验室欲证明H2能在加热的条件下还原FeCl3,设计如下实验。下列说法错误的是

A.装置A的优点是随开随用,随关随停
B.导管m的作用是平衡压强,观察是否堵塞
C.装置D中产生白色沉淀即可证明H2能还原FeCl3
D.实验结束后,应先熄灭C处酒精灯,待硬质玻璃管冷却后关闭K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴(III)([Co(NH3)6]Cl3)是合成其它含钴配合物的重要原料。制备流程如下:
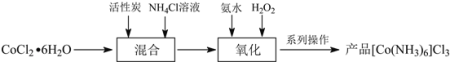
(1) “混合”步骤需在煮沸NH4Cl溶液中加入研细的CoCl2·6H2O晶体,加热煮沸的目的是______。
(2)流程中加入![]() 溶液可防止加氨水时溶液中c(OH)过大,其原理是______。
溶液可防止加氨水时溶液中c(OH)过大,其原理是______。
(3)“氧化”步骤中应先加入氨水再加入![]() ,理由是______。
,理由是______。
(4)为测定产品中钴的含量,进行下列实验:
①称取样品4.000g于烧瓶中,加80mL水溶解,加入15.00mL 4molL-1NaOH溶液,加热至沸15~20min,冷却后加入15.00mL 6molL-1HCl溶液酸化,将![]() 转化成Co3+,一段时间后,将烧瓶中的溶液全部转移至250.00mL容量瓶中,加水定容,取其中25.00 mL试样加入到锥形瓶中;
转化成Co3+,一段时间后,将烧瓶中的溶液全部转移至250.00mL容量瓶中,加水定容,取其中25.00 mL试样加入到锥形瓶中;
②加入足量KI晶体,充分反应;
③![]() 加入淀粉溶液作指示剂,用0.1000molL-1Na2S2O3标准溶液滴定至终点,再重复2 次,测得消耗Na2S2O3溶液的平均体积为15.00mL。(已知:2Co3++2I=2Co2++I2,I2+2S2O32-=2I+S4O62-),通过计算确定该产品中钴的含量(写出计算过程)。______
加入淀粉溶液作指示剂,用0.1000molL-1Na2S2O3标准溶液滴定至终点,再重复2 次,测得消耗Na2S2O3溶液的平均体积为15.00mL。(已知:2Co3++2I=2Co2++I2,I2+2S2O32-=2I+S4O62-),通过计算确定该产品中钴的含量(写出计算过程)。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置 (夹持装置已略)如图所示:下列说法错误的是( )
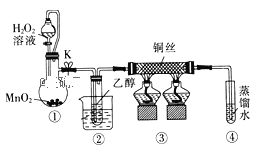
A.向圆底烧瓶中滴入H2O2溶液前需打开K
B.实验开始时需先加热②,再通O2,然后加热③
C.装置③中发生的反应为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.实验结束时需先将④中的导管移出,再停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(4)小题用元素符号或化学式回答,(5)~(8)小题按题目要求回答。
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是___,只有负价而无正价的是___,氧化性最强的单质是___,还原性最强的单质是___。
<>(2)最高价氧化物的水化物中碱性最强的是___,酸性最强的是___,呈两性的是___。(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是___。
(4)在B、C、E、F、G、H中,原子半径最大的是___。
(5)用电子式表示B和H组成化合物的形成过程___,它属于___化合物(填“离子”或“共价”)。
(6)写出B的最高价氧化物的水化物和H的单质反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.32 g S8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
B.2 g由H2![]() 和2H2O组成的物质中含有的质子数为NA
和2H2O组成的物质中含有的质子数为NA
C.8 g CuO与足量H2充分反应生成Cu,该反应转移的电子数为0.2NA
D.2.3 g Na与O2完全反应,反应中转移的电子数介于0.1NA和0.2NA之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,△H1=-393.5 kJmol-1,△H2=-395.4 kJmol-1,下列说法或表示式正确的是( )
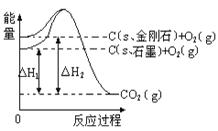
A. C(s、石墨)==C(s、金刚石)△H=+1.9kJmol-1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性强于石墨
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Cu(Ⅱ)盐晶体组成可表示为Ka[Cub(C2O4)c]·dH2O,为测定其组成,实验如下:
(1)溶液的配制
准确称取3.540 g样品,加入1mol·L-1H2SO4溶解,配制成100mL溶液。所需要的玻璃仪器有量筒、烧杯、胶头滴管、____、______。
(2)铜含量的测定
取所配溶液25.00mL于锥形瓶中,加入过量淀粉—KI溶液,充分反应后,生成的I2与12.50mL0.2000mol·L-1Na2S2O3恰好完全反应。已知:2Cu2++4I-=2CuI↓+I2,I2+2S2O32—= 2I-+S4O62—。判断生成的I2与Na2S2O3恰好完全反应的现象为______。3.540 g样品中n(Cu2+)=_____mol。
(3)草酸根含量的测定
取另一份所配溶液25.00mL于锥形瓶中,滴入0.1000 mol·L-1KMnO4溶液至恰好完全反应,消耗20.00 mL KMnO4溶液。已知:2MnO4—+5C2O42—+16H+=2Mn2++8H2O+10CO2↑,所配溶液中c(C2O42—)=____mol·L-1。
(4)计算该铜盐的组成(写出计算过程)____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com