
 往含有少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生如图变化,四条曲线(c和d图象部分重叠)溶液中离子的对应关系,正确的是( )
往含有少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生如图变化,四条曲线(c和d图象部分重叠)溶液中离子的对应关系,正确的是( )| A. | a:Cl-b:K+ c:CO32- d:HCO3- | |
| B. | a:K+ b:CO32- c:Cl- d:HCO3- | |
| C. | a:K+ b:CO32- c:HCO3- d:Cl- | |
| D. | a:K+ b:HCO3- c:Cl- d:CO32- |
分析 根据向一定量的K2CO3溶液中缓慢地滴加稀盐酸,则先后发生K2CO3+HCl═KCl+KHCO3、KHCO3+HCl═KCl+CO2↑+H2O,则钾离子数目不发生变化,氯离子的数目在增加,碳酸根离子的数目一直在减少,直到为0,碳酸氢根离子的数目先增大后减小,直到为0,然后结合图象来分析对应的离子.
解答 解:因向一定量的K2CO3溶液中缓慢地滴加稀盐酸,先后发生如下反应,K2CO3+HCl═KCl+KHCO3、KHCO3+HCl═KCl+CO2↑+H2O,则钾离子的数目不变,则图中a为K+离子;
碳酸根离子在减少,直至为0,则图中b为CO32-离子,碳酸氢根离子先增大后减小,直至为0,则图中c为HCO3-离子,氯离子先为0,随盐酸的加入氯离子的数目在增多,则d为Cl-离子,
根据分析可知:a:K+、b:CO32-、c:HCO3-、d:Cl-,
故选C.
点评 本题考查离子反应及其应用,题目难度中等,明确离子反应的实质并学会结合图象来判断离子数目是解答的关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下: ,存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯.有关数据列如下表:
,存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯.有关数据列如下表:| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
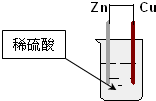
| A. | 铜片表面有气泡产生 | B. | 负极反应为:Cu-2e-=Cu2+ | ||
| C. | 锌为负极,铜为正极 | D. | 电子通过锌片经导线流向铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A. | 若平衡浓度符合下列关系式:$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,则此时的温度为1000℃ | |
| B. | 上述反应的逆反应是放热反应 | |
| C. | 该反应的化学方程式是:CO2(g)+H2(g)?CO(g)+H2O(g) | |
| D. | 若在一定体积的密闭容器中通入CO2和H2各1mol,5min后温度升高到830℃,此时测得CO2为0.4mol时,该反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
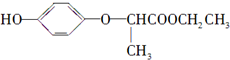 下列有关HPE的说法正确的是( )
下列有关HPE的说法正确的是( )| A. | 1 mol HPE最多可和2 mol NaOH反应 | |
| B. | HPE不能跟浓溴水反应 | |
| C. | HPE不能发生加成反应 | |
| D. | HPE在核磁共振氢谱中有6个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
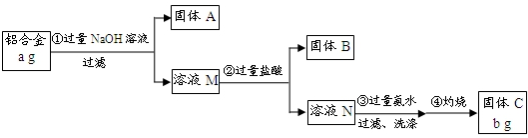
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 盐酸体积(mL) | 5 | 15 | 20 | 50 | x | 120 | 150 |
| 生成CO2体积(mL) | 0 | 224 | 448 | 1792 | 4480 | 4480 | 4480 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com