
【题目】对硝基甲苯(![]() )是医药、染料等工业的一种重要有机中间体,一种制备对硝基甲苯的实验步骤如下:
)是医药、染料等工业的一种重要有机中间体,一种制备对硝基甲苯的实验步骤如下:
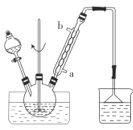
步骤1:向三颈烧瓶中加入甲苯(液态),以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),以CCl4为溶剂,乙酸酐为脱水剂(与水反应生成乙酸),45℃下搅拌、回流1h。实验装置如图所示(加热和仪器固定装置均已略去)。
步骤2反应结束后,过滤,滤液分别用5%NaHCO3溶液、水洗至中性。
步骤3:所得液体再经分离提纯得到对硝基甲苯。
(1)装置中,冷却水应从______________(填“a”或“b”)口通入。
(2)反应须控制在45℃下进行的原因是______________。
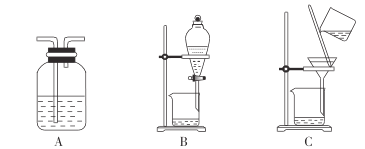
(3)步骤2中,过滤所得滤渣是______________(填化学式);对滤液进行洗涤可用下列装置中的______________(填字母)。
(4)表中所给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
n(甲苯) | 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | ||
浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
NaHSO4 | 0.15 | 44.6 | 55.l | 0.3 | 98.9 |
0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
0.36 | 45.2 | 54.2 | 0.6 | 99.9 | |
已知:对硝基甲苯、邻硝基甲苯和间硝基甲苯的沸点分别为238.5℃、222℃和230.5℃。
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为______________,
②与浓硫酸作催化剂相比,NaHSO4作催化剂的优点有______________、______________。
③步骤3中,从三种异构体的混合物中分离出对硝基甲苯的方法为______________。
【答案】a 减少反应物的挥发和分解.提高反应物的利用率,减少副反应的发生.提高产率 NaHSO4 B 0.32 产物中对硝基甲苯比例高;催化剂用量少 催化剂能循环使用 蒸馏
【解析】
(1)冷却水低进高出,可以提高冷凝效果;
(2)硝酸易分解、挥发;
(3) 固体NaHSO4难溶于有机物;对硝基甲苯等有机物是难溶于水的液体;
(4)①制备对硝基甲苯时,对硝基甲苯的比例越大越好;
②由表格数据可知,固体NaHSO4为催化剂,对硝基甲苯的比例高;固体NaHSO4易分离;
③对硝基甲苯、邻硝基甲苯和间硝基甲苯的沸点不同;
(1)冷却水低进高出,可以提高冷凝效果,冷却水应从a口通入;
(2) 为减少反应物的挥发和分解,提高反应物的利用率,反应须控制在45℃下进行 ;
(3) 固体NaHSO4为催化剂,难溶于有机物,所以步骤2中,过滤所得滤渣是NaHSO4;对硝基甲苯等有机物是难溶于水的液体,用5%NaHCO3溶液、水洗涤后需要分液,故选B;
(4)①制备对硝基甲苯,对硝基甲苯的比例越大越好,所以NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为0.32;
②由表格数据可知,固体NaHSO4为催化剂,产物中对硝基甲苯比例高;固体NaHSO4易分离,能循环使用;
③对硝基甲苯、邻硝基甲苯和间硝基甲苯的沸点不同,从三种异构体的混合物中分离出对硝基甲苯的方法为蒸馏。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸胺(H2NCOONH4)固体,置于特制密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使反应: H2NCOONH4(s)![]() 2NH3(g)+CO2(g)达到分解平衡,实验测得不同温度及反应时间(t1<t2<t3)的有关表格:
2NH3(g)+CO2(g)达到分解平衡,实验测得不同温度及反应时间(t1<t2<t3)的有关表格:
氨基甲酸铵分解时温度、气体总浓度及反应时间的关系。
温度/℃ 气体总浓度(mol/L) 时间/min | 15 | 25 | 35 |
0 | 0 | 0 | 0 |
t1 | 0.9×10-3 | 2.7×10-3 | 8.1×10-3 |
t2 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
t3 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
(1)在25℃,0-t1时间内产生氨气的平均速率为___。
(2)根据表中数据换算出,15℃时合成反应2NH3(g)+CO2(g)![]() H2NCOONH4(s)平衡常数K约为___。
H2NCOONH4(s)平衡常数K约为___。
(3)以捕捉到的CO2与H2为原料可合成甲醇(CH3OH),其反应的化学方程为:CO2(g)+3H2(g)![]() CH3OH(g)+H2(g) ΔH<0在恒温恒容的密闭容器中,加入1molCO2和3molH2,充分反应达平衡时放出热量akJ,若在原容器中加入2molCO2和6molH2,在相同温度下反应达平衡时放热bkJ,则a和b满足的关系___。
CH3OH(g)+H2(g) ΔH<0在恒温恒容的密闭容器中,加入1molCO2和3molH2,充分反应达平衡时放出热量akJ,若在原容器中加入2molCO2和6molH2,在相同温度下反应达平衡时放热bkJ,则a和b满足的关系___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:

相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为_______________________。
(2)滤渣1的主要成分除SiO2外还有___________;氧化除杂工序中ZnO的作用是____________,若不通入氧气,其后果是________________。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为_________________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为______________;沉积锌后的电解液可返回_______工序继续使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铂—铑合金网上发生反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。该反应是一个自发的反应且铂—铑合金网未预热也会发热,下列像图不正确的是
4NO(g)+6H2O(g)。该反应是一个自发的反应且铂—铑合金网未预热也会发热,下列像图不正确的是
A. B.
B.
C. D.
D.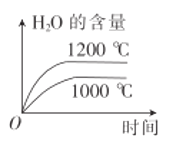
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化中包括许多科技知识。下列古语中不涉及化学变化的是( )
A.熬胆矾(CuSO4·5H2O)铁釜,久之亦化为铜B.千淘万漉虽辛苦,吹尽狂沙始到金
C.凡石灰(CaCO3)经火焚炼为用D.丹砂(HgS)烧之成水银,积变又成丹砂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表中短周期的一部分,若A原子最外层的电子数比次外层少3,则下列说法正确的是( )
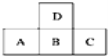
A.只有A的单质存在同素异形体
B.D的最高正价比A大
C.A、B、C的最高价氧化物对应水化物的酸性强弱的关系是C<B<A
D.离子半径的大小顺序是A>B>C>D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟合成氨和氨催化氧化的流程如下:
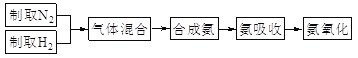
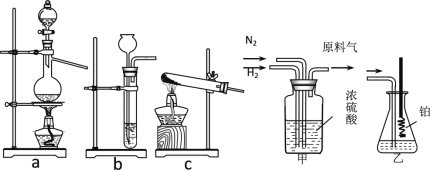
已知:实验室用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从图中选择制取气体的合适装置:氮气__、氢气___。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有__、_。
(3)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:_,锥形瓶中还可观察到的现象是:____。
(4)写出乙装置中氨氧化的化学方程式:_____。
(5)反应结束后锥形瓶内的溶液中含有H+、OH-、_、_离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭系统中有反应C(s)+CO2(g)![]() 2CO(g),能使反应速率加快的措施是
2CO(g),能使反应速率加快的措施是
①通过减小容器体积增大压强 ②升高温度③将炭粉碎 ④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2
A.①②③④B.①②④⑥C.①②③⑥D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以芳香烃A(苯环上只有一个侧链)为原料发生如图所示的变化,可以合成高聚物G。

已知:①两个羟基连在同一碳原子上不稳定,会自动脱水。如: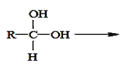 R—CHO
R—CHO
②C能发生银镜反应,F能使溴水褪色。
回答下列问题:
(1)A中官能团的名称是___;C的结构简式为___。
(2)B→C的反应条件是___,E→F的反应类型是___。
(3)写出E→G的化学方程式___。
(4)E的同分异构体中,苯环上有3个取代基、遇FeCl3溶液显紫色且能与碳酸氢钠溶液反应的共有___种(不考虑立体异构)。
(5)参照上述合成路线,设计以丙炔为原料制备乳酸(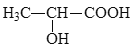 )的合成路线___(无机试剂任选)。
)的合成路线___(无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com