

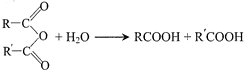
 ,G
,G

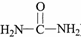 )氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式
)氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式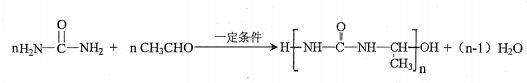
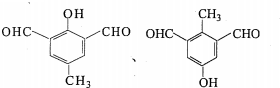 任意一种.
任意一种.分析 A是一种烃的含氧衍生物,其相对分子质量小于100,碳、氢元素质量分数之和为82.98%,则分子中O原子最大数目为$\frac{100×(1-82.98%)}{16}$≈1.1,则氧原子数目为1,故Mr(A)=$\frac{16}{1-82.98%}$=94,分子中C、H原子总相对原子质量为94-16=78,则分子中C原子最大数目$\frac{78}{12}$=6…6,则分子中C、H原子数目均为6,则A的分子式为C6H6O,A转化得到B,结合B的结构简式可知A为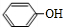 ,C与银氨溶液反应、酸化得到D,D转化得到E,结合D的分子式与E的结构简式可知D为CH3COOH、C为CH3CHO,由F的结构简式可知,B与E发生加成反应得到F,对比G的分子式与F的结构、结合H的结构简式可知,F发生消去反应得到G,则G为
,C与银氨溶液反应、酸化得到D,D转化得到E,结合D的分子式与E的结构简式可知D为CH3COOH、C为CH3CHO,由F的结构简式可知,B与E发生加成反应得到F,对比G的分子式与F的结构、结合H的结构简式可知,F发生消去反应得到G,则G为 ,G发生酯的水解反应得到H,结合Y的结构简式可知,H分子内脱去1分子水得到Y.由X的结构片段可知,苯酚与乙醛发生缩聚反应得到X.
,G发生酯的水解反应得到H,结合Y的结构简式可知,H分子内脱去1分子水得到Y.由X的结构片段可知,苯酚与乙醛发生缩聚反应得到X.
解答 解:A是一种烃的含氧衍生物,其相对分子质量小于100,碳、氢元素质量分数之和为82.98%,则分子中O原子最大数目为$\frac{100×(1-82.98%)}{16}$≈1.1,则氧原子数目为1,故Mr(A)=$\frac{16}{1-82.98%}$=94,分子中C、H原子总相对原子质量为94-16=78,则分子中C原子最大数目$\frac{78}{12}$=6…6,则分子中C、H原子数目均为6,则A的分子式为C6H6O,A转化得到B,结合B的结构简式可知A为 ,C与银氨溶液反应、酸化得到D,D转化得到E,结合D的分子式与E的结构简式可知D为CH3COOH、C为CH3CHO,由F的结构简式可知,B与E发生加成反应得到F,对比G的分子式与F的结构、结合H的结构简式可知,F发生消去反应得到G,则G为
,C与银氨溶液反应、酸化得到D,D转化得到E,结合D的分子式与E的结构简式可知D为CH3COOH、C为CH3CHO,由F的结构简式可知,B与E发生加成反应得到F,对比G的分子式与F的结构、结合H的结构简式可知,F发生消去反应得到G,则G为 ,G发生酯的水解反应得到H,结合Y的结构简式可知,H分子内脱去1分子水得到Y.由X的结构片段可知,苯酚与乙醛发生缩聚反应得到X.
,G发生酯的水解反应得到H,结合Y的结构简式可知,H分子内脱去1分子水得到Y.由X的结构片段可知,苯酚与乙醛发生缩聚反应得到X.
(l)C为CH3CHO,官能团名称为:醛基,故答案为:醛基;
(2)A的结构简式为 ,G的结构简式为:
,G的结构简式为: ,
,
故答案为: ;
; ;
;
(3)a.B与E生成F是甲基与醛发生的加成反应,故a正确;
b.G为 ,苯环、碳碳双键能与氢气发生加成反应,1molG最多能与4molH2发生加成反应,故b错误;
,苯环、碳碳双键能与氢气发生加成反应,1molG最多能与4molH2发生加成反应,故b错误;
c.Y含有羧酸与酚形成的酯基,水解得到羧基、酚羟基,与氢氧化钠水溶液反应时,1molY最多能消耗2mol NaOH,故c正确,
故答案为:ac;
(4)H生成Y的化学方程式为: ,
,
故答案为: ;
;
(5)尿素 氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物,尿素与C在一定条件下生成线性高分子化合物的化学方程式:
氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物,尿素与C在一定条件下生成线性高分子化合物的化学方程式: ,
,
故答案为: ;
;
(6)H的同分异构体中能同时满足如下条件:①可发生银镜反应,说明含有醛基,②只含有一个环状结构且可使FeCl3溶液显紫色,说明含有酚羟基,③核磁共振氢谱为四组峰,且峰面积比为3:2:2:1,符合条件同分异构体有: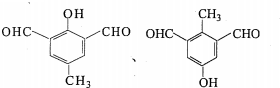 ,
,
故答案为:2;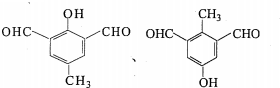 任意一种.
任意一种.
点评 本题考查有机物的推断与合成,充分利用转化中有机物的分子式与结构简式进行分析,熟练掌握官能团的性质与转化,较好的考查学生分析推理能力、知识迁移应用能力.


科目:高中化学 来源: 题型:解答题
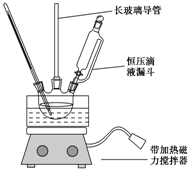 硝基苯是重要的化工原料,用途广泛.实验室用如图装置制备硝基苯,步骤如下:
硝基苯是重要的化工原料,用途广泛.实验室用如图装置制备硝基苯,步骤如下:| 物 质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 浓硝酸 | - | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
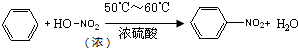 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难溶电解质Ag2SO4的饱和溶液中,若c(SO42-)=amol•L-1,则Ksp(Ag2SO4)=2a3 | |
| B. | 某氨水的pH=11,将此溶液稀释10倍后,溶液的pH<10 | |
| C. | Ka(HCN)<Ka(CH3COOH),说明相同温度下同浓度的HCN溶液的酸性比CH3COOH溶液的强 | |
| D. | pH=8的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2与CH3CH2OH均可以使KMnO4(H+)褪色,且褪色原理相同 | |
| B. | 乙酸乙酯的制取中,水浴加热的目的有:加快化学反应速率,同时使产物分离,平衡正向移动 | |
| C. | 等质量的CH3CH2OH与CH3COOH,均能与足量的金属钠发生取代反应,前者反应速率较后者慢,且生成等物质量的H2 | |
| D. | 在一溴乙烷中加入NaOH和CH3CH2OH,加热,加入HNO3酸化的AgNO3,出现淡黄色沉淀,说明溴乙烷发生了水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:4:3 | B. | 2:4:5 | C. | 2:4:7 | D. | 3:5:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 X、Y、Z、W四种元素原子序数依次增大且均小于36.Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子.回答下列问题(以下问题均以推知元素符号作答):
X、Y、Z、W四种元素原子序数依次增大且均小于36.Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子.回答下列问题(以下问题均以推知元素符号作答):查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com