
| A. | 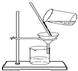 分离FeCl3溶液和蔗糖溶液 | B. |  称量8.55g氯化钠固体 | ||
| C. | 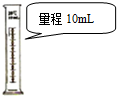 量取9.50 mL水 | D. | 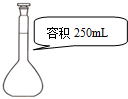 配制240 mL 0.1mol/L的NaCl溶液 |
分析 A.FeCl3溶液和蔗糖溶液互溶,没有沉淀;
B.托盘天平的感量为0.1g;
C.量筒的感量为0.1mL;
D.容量瓶的规格应与配制溶液的体积相近,使用固定规格的容量瓶.
解答 解:A.FeCl3溶液和蔗糖溶液互溶,没有沉淀,不能使用过滤装置分离,故A错误;
B.托盘天平的感量为0.1g,可称量8.5g或8.6g氯化钠固体,故B错误;
C.量筒的感量为0.1mL,则10mL量筒可量取9.5 mL水,故C错误;
D.容量瓶的规格应与配制溶液的体积相近,使用固定规格的容量瓶,则配制240 mL 0.1mol/L的NaCl溶液,选择25omL容量瓶,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、仪器的使用、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
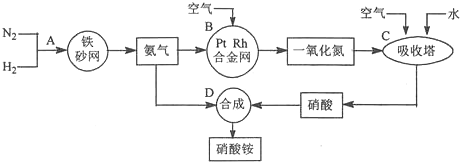
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol甲烷(CH4)分子中所含电子数为9NA | |
| B. | 24g镁原子的最外层电子数为NA | |
| C. | 在标准状况下,1 mol H2和1mol H2O所占的体积都约是22.4L | |
| D. | 在标准状况下,22.4L由N2和N2O组成的混合气体中,所含有的氮原子的物质的量2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.8 g熔融KHSO4 与3.9 g熔融Na2O2 中阴离子数目相同 | |
| B. | 某金属阳离子的结构示意图为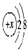 ,其与Cl-形成的强电解质都是离子化合物 ,其与Cl-形成的强电解质都是离子化合物 | |
| C. | 二硫化碳与二氧化碳结构相似,其电子式为 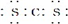 | |
| D. | 中子数为18的氯原子可表示为18Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个N2分子与NA个CO分子的质量比为1﹕1 | |
| B. | 水的摩尔质量等于NA个水分子的质量 | |
| C. | 在常温常压下,11.2LSO2含有的分子数为0.5NA | |
| D. | 1L 0.1mol•L-1Na2SO4溶液中有0.1NA个Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
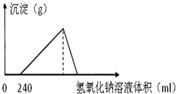 将5.1g的氧化铝溶于一定浓度的500mL的盐酸中,充分反应后,再逐滴加入0.5mol/L的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示,试计算:
将5.1g的氧化铝溶于一定浓度的500mL的盐酸中,充分反应后,再逐滴加入0.5mol/L的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示,试计算:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com