
【题目】关于下列各装置图的叙述不正确的是( )
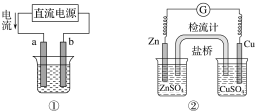
A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
【答案】B
【解析】
A.用图①装置实现铁上镀铜,根据电流的移动方向可知a极为阳极,是铜电极,b电极为Fe电极,电解质溶液可以是CuSO4溶液,A正确;
B.Zn电极为负极,Cu电极为正极,负极Zn失去电子变为Zn2+进入溶液,根据异种电荷相互吸引的原则,在含有盐桥的原电池中,盐桥中阴离子流向负极区、阳离子流向正极区,该装置中Zn作负极、Cu作正极,所以盐桥中KCl的Cl-移向左烧杯,B错误;
C.电解池阴极与电源的负极连接,金属被保护,电解池阳极的金属与电源正极连接而加速被腐蚀,要保护钢铁,则钢铁连接原电池负极,C正确;
D.在左边的原电池中Al为负极,Al是+3价的金属,每27gAl会失去3mol电子;右边的原电池中Zn是负极,Zn是+2价的金属,65gZn会失去2mol电子,所以图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同,D正确;
故合理选项是B。


科目:高中化学 来源: 题型:
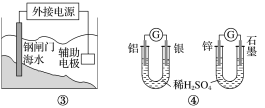
【题目】最近,中国科学院大连化物所“CO2催化转化为CO的研究”获得新进展。如图是使用不同催化剂(NiPc和CoPc)时转化过程中的能量变化,下列说法不合理的是( )
A.CO2经还原反应得到COOH
B.该研究成果将有利于缓解温室效应,并解决能源转化问题
C.相同基团的物种分别吸附在NiPc和CoPc表面,其能量可能不同
D.催化剂可以改变CO2转化为CO反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铜与过量浓硫酸反应的实验说法不正确的是( )
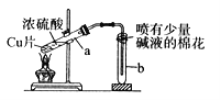
A. 喷有碱液的棉花是为了防止SO2污染环境
B. 将水注入反应后冷却的试管a中,溶液变为蓝色
C. 铜片表面先发黑,反应完全后试管a底部有白色固体
D. 反应的化学方程式是Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T-carbon(又名T-碳),是中国科学院大学苏刚教授研究团队于2011年通过理论计算预言的一种新型三维碳结构,经过不懈的努力探索,2017年终于被西安交大和新加坡南洋理工大学联合研究团队在实验上成功合成,证实了理论预言。T-碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代形成碳的一种新型三维立方晶体晶胞结构,如图。下列说法错误的是( )
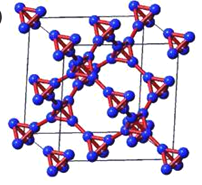
A. 每个T-碳晶胞中含32个碳原子
B. T-碳密度比金刚石小
C. T-碳中碳与碳的最小夹角为109.5°
D. 由于T-碳是一种蓬松的碳材料,其内部有很大空间可供利用,可能可以用作储氢材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、M均为短周期主族元素。25℃时,各元素最高价氧化物对应的水化物溶液(浓度均为0.01mol/L)的pH和原子半径的关系如图所示。下列说法不正确的是( )
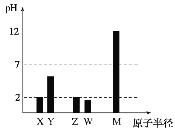
A. 从图中得出同浓度下W的最高价氧化物对应的水化物的pH比Z小,故非金属性:W>Z
B. X、Z的最简单气态氢化物在常温下可以反应生成离子化合物
C. X、Y、Z、W、M五种元素单质中Y常见单质熔点最高
D. 简单离子半径大小顺序:X>M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“达芦那韦”是抗击新型冠状病毒潜在用药,化合物Qs是它的合成中间体,其合成路线如图:
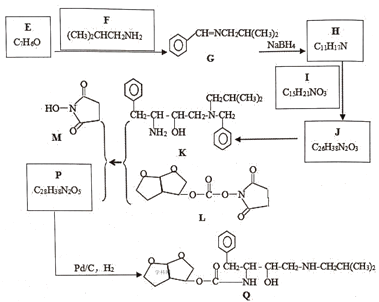
已知:R1CHO![]() R1—CH=N—R2
R1—CH=N—R2
(1)下列说法不正确的是__。
A.有机物E所有原子一定共平面
B.核磁共振、质谱、红外光谱等可用于测定有机物I的结构
C.H→J是加成反应
D.有机物Q分子式C21H33N2O5
(2)写出化合物H的结构简式__。
(3)写出K+L=M+P的化学方程式__。
(4)设计从苯甲醇和CH3NH2为原料制备![]() 的合成路线用流程图表示,无机试剂任选)__。
的合成路线用流程图表示,无机试剂任选)__。
(5)有机物R是相对分子质量比F大14的同系物。R的1H—NMR谱表明分子中有3种氢原子,写出R符合条件的所有同分异构体的结构简式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是中学化学常见物质,它们有如图转化关系(反应条件和其它产物省略),有关描述错误的是
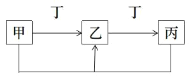
A.若甲为氢氧化钠溶液,则丁可能为二氧化碳
B.若乙为淡黄色固体,则丙一定为二氧化硫
C.若乙为两性氢氧化物,则丁溶液可能碱性
D.若丁是铁单质,则甲一定为氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。

(1)打开K2,合并K1。A的电极反应为________。最终可观察到的现象是________________。
(2)打开K1,合并K2。F极的电极反应为_______,检验F极产生气体的方法是____________。
(3)若往U形管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是_____,原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮是重要的非金属元素,在生产、生活中有广泛的应用。
(1)已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l) ![]() C6H12O6(s)+6O2(g) △H=+669.62 kJmol-1该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是__________。
C6H12O6(s)+6O2(g) △H=+669.62 kJmol-1该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是__________。
a.增大CO2的浓度 b.取走一半C6H12O6
c.加入催化剂 d.适当升高温度
(2)N2O5的分解反应2N2O5(g)![]() 4NO2(g) + O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g) + O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
c(N2O5) /(molL﹣1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
计算在0~2min时段,化学反应速率v(NO2) =________molL-1min-1。
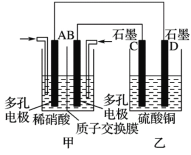
(3)若将NO2与O2通入甲中设计成如图所示装置,D电极上有红色物质析出,则A电极处通入的气体为_________(填化学式);A电极的电极反应式为_______________________,一段时间后,若乙中需加0.2 mol Cu(OH)2使溶液复原,则转移的电子的物质的量为 _____________。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如下图
N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如下图
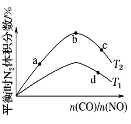
①b点时,平衡体系中C、N原子个数之比接近________________;
②a、b、c三点CO的转化率从大到小的顺序为____________;a、c、d三点的平衡常数从大到小的顺序为__________________。
③若![]() =0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为___________。
=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com