
T ��ʱ��2 L�ܱ�������ʹX(g)��Y(g)������Ӧ����Z(g)����Ӧ������X��Y��Z�����ʵ����仯��ͼ1��ʾ�������������������䣬�¶ȷֱ�ΪT1��T2ʱ��Y�İٷֺ�����ʱ��Ĺ�ϵ��ͼ2��ʾ�������н�����ȷ����( )
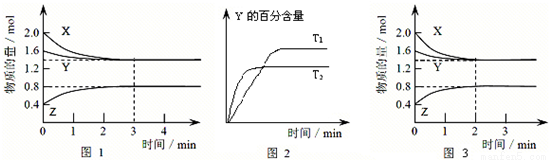
A����Ӧ���е�ǰ3 min�ڣ���X��ʾ�ķ�Ӧ����v(X)��0.3 mol��L��1��min��1
B�������з����ķ�Ӧ�ɱ�ʾΪ��3X(g)��Y(g) = 2Z(g)
C�����������������䣬�����¶ȣ���Ӧ�Ļ�ѧƽ�ⳣ��K����
D�����ı䷴Ӧ������ʹ��Ӧ������ͼ3��ʾ����ı������������ѹǿ
C
��������
���������A����ͼ1��֪����Ӧ���е�ǰ3 min�ڣ���X��ʾ�ķ�Ӧ����v(X)��(2.0mol-1.4mol)��2L��3min=0.1 mol��L��1��min��1.����B����ͼ1��֪��ǰ�������ڸ������ʵ����ʵ����仯Ϊ��X��0.6mol;Y��0.2mol;Z��0.4mol���������ʵ����ʵ����ı仯��ֵ�ı�Ϊ����ʽ�и����ʵļ������ıȣ�����Ӧ���������Ӻ�������ʶ��У�����Ϊ0 ������ǿ��淴Ӧ�����������з����ķ�Ӧ�ɱ�ʾΪ��3X(g)��Y(g)  2Z(g)������C����ͼ2��֪�����¶�ΪT2ʱ�ȴﵽƽ�⣬��T2>T1�����¶�ΪT2ʱ�ﵽƽ��Y�ĺ�����T1ʱ�͡�˵���������������䣬�����¶ȣ�ƽ��������Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ�������Ӧ����Ϊ���ȷ�Ӧ����������¶ȣ���Ӧ�Ļ�ѧƽ�ⳣ��K������ȷ��D����ͼ3���Կ�����ͼ1��ǰ1min�ﵽƽ�⣬����ƽ��ʱ�����ʵ�Ũ�ȡ��������䣬����ƽ��δ�����ƶ������ڸ÷�Ӧ�Ƿ�Ӧǰ������������ȵĿ��淴Ӧ������������ѹǿ����Ӧ���ʼӿ죬��ѧƽ��������Ӧ�����ƶ���ƽ��ʱ���ʵĺ����仯������Ӧ���Ǽ������������
2Z(g)������C����ͼ2��֪�����¶�ΪT2ʱ�ȴﵽƽ�⣬��T2>T1�����¶�ΪT2ʱ�ﵽƽ��Y�ĺ�����T1ʱ�͡�˵���������������䣬�����¶ȣ�ƽ��������Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ�������Ӧ����Ϊ���ȷ�Ӧ����������¶ȣ���Ӧ�Ļ�ѧƽ�ⳣ��K������ȷ��D����ͼ3���Կ�����ͼ1��ǰ1min�ﵽƽ�⣬����ƽ��ʱ�����ʵ�Ũ�ȡ��������䣬����ƽ��δ�����ƶ������ڸ÷�Ӧ�Ƿ�Ӧǰ������������ȵĿ��淴Ӧ������������ѹǿ����Ӧ���ʼӿ죬��ѧƽ��������Ӧ�����ƶ���ƽ��ʱ���ʵĺ����仯������Ӧ���Ǽ������������
���㣺���黯ѧ����ʽ��ȷ�����¶ȡ�ѹǿ�Ի�ѧƽ�⼰ƽ�ⳣ����Ӱ���֪ʶ��


 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�찲��ʡ��У�����о��������һ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
ˮ�ȷ��Ʊ�ֱ��Ϊ1~100 nm�Ŀ���Y�����������Ӧԭ��Ϊ��3Fe2+ + 2S2O32- + O2 + aOH��= Y+ S4O62- + 2H2O������˵���в���ȷ����
A��a��4
B����Y���ȷ�ɢ��ˮ���γɵ���ϵ���ж����ЧӦ
C��S2O32-�ǻ�ԭ��
D��ÿ��3 mol Fe2+ �μӷ�Ӧ����Ӧ��ת�Ƶĵ�������Ϊ5 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�찲��������ѧͬ����ʱ�����˽�ѡ��4��2.1 ��ѧ��Ӧ�����Ծ��������棩 ���ͣ�ѡ����
�ڿ��淴Ӧ2A(g)+3B(g)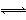 xC(g)+D(g)�У���֪����Ӧ��ʼ���������ֻ��A��B����ʼŨ��A Ϊ5 mol��L-1��BΪ3 mol��L-1��ǰ2 min C��ƽ����Ӧ����Ϊ0��5 mol��L-1��min-1��2 min���D��Ũ��Ϊ0��5 mol��L-1������ڴ˷�Ӧ������˵������ȷ����(����)
xC(g)+D(g)�У���֪����Ӧ��ʼ���������ֻ��A��B����ʼŨ��A Ϊ5 mol��L-1��BΪ3 mol��L-1��ǰ2 min C��ƽ����Ӧ����Ϊ0��5 mol��L-1��min-1��2 min���D��Ũ��Ϊ0��5 mol��L-1������ڴ˷�Ӧ������˵������ȷ����(����)
A��2 minĩʱA��B��Ũ��֮��Ϊ5��3
B��x=1
C��2 minĩʱB��Ũ��Ϊ1��5 mol��L-1
D��2 minĩʱA������Ũ��Ϊ0��5 mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�찲��ʦ���и߶���ѧ�����п��黯ѧ�Ծ��������棩 ���ͣ������
ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̡�
��1����ˮ����ͨ�����ȵ�̿���ɲ���ˮú������ӦΪ��C(s)��H2O(g)  CO(g)��H2(g) ��H����131.3 kJ��mol��1 һ���¶��£���һ���ݻ��ɱ���ܱ������У�����������Ӧ���������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬���� (����ĸ����ͬ)
CO(g)��H2(g) ��H����131.3 kJ��mol��1 һ���¶��£���һ���ݻ��ɱ���ܱ������У�����������Ӧ���������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬���� (����ĸ����ͬ)
A�������е�ѹǿ����
B��1 mol H��H�����ѵ�ͬʱ����2 mol H��O��
C��v��(CO)��v��(H2O)
D��c(CO)��c(H2)
��2������ͬ����CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2 L�ĺ����ܱ������У����з�ӦCO(g)��H2O(g)  CO2(g)��H2(g)���õ������������ݣ�
CO2(g)��H2(g)���õ������������ݣ�
ʵ �� �� | �� �� /�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
�ٸ÷�Ӧ���淴ӦΪ (������š�)�ȷ�Ӧ��
����ʵ��3Ҫ�ﵽ��ʵ��2��ͬ��ƽ��״̬(�������ʵ����������ֱ����)����t<3 min����a��bӦ����Ĺ�ϵ�� (�ú�a��b����ѧʽ��ʾ)��
(3)Ŀǰ��ҵ����һ�ַ�������CO2�������״���һ�������·�����Ӧ��CO2(g)+3H2(g)  CH3OH(g) +H2O(g)����ͼ��ʾ�÷�Ӧ���й���������(��λΪkJ��mol��1)�ı仯�������Ϊ1 L�ĺ����ܱ������У�����1 mol CO2��3 mol H2�� ���д�ʩ����ʹ c(CH3OH)�������
CH3OH(g) +H2O(g)����ͼ��ʾ�÷�Ӧ���й���������(��λΪkJ��mol��1)�ı仯�������Ϊ1 L�ĺ����ܱ������У�����1 mol CO2��3 mol H2�� ���д�ʩ����ʹ c(CH3OH)�������
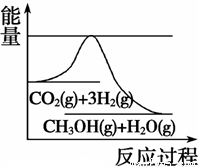
A�������¶�
B������N2(g)��ʹ��ϵѹǿ����
C����H2O(g)����ϵ�з������
D���ٳ���0.5 mol CO2��1.5 mol H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�찲��ʦ���и߶���ѧ�����п��黯ѧ�Ծ��������棩 ���ͣ�ѡ����
����ͬ�����£�T=500K������ͬ����ļ��������������г���1gSO2��1gO2�����г���2gSO2��2gO2�����������в���ȷ����( )
A����Ӧ���ʣ���>�� B��ƽ��������SO2�������������>��
C��SO2��ת���ʣ���>�� D��ƽ��ʱO2��Ũ�ȣ���>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�찲��ʦ���и߶���ѧ�����п��黯ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����( )
A����100 �桢101 kPa�����£�Һ̬ˮ��������Ϊ40.69 kJ��mol-1����H2O(g) H2O(l) �� ��H = ��40.69 kJ��mol-1
H2O(l) �� ��H = ��40.69 kJ��mol-1
B����25�桢101kPa��2mol S��ȼ������1mol S��ȼ����2��
C��CH4(g) +2O2(g) = CO2(g) +2H2O(g) ��H����akJ��mol-1 �����捻H����ȼ����
D����֪��
���ۼ� | C��C | C=C | C��H | H��H |
����/ kJ��mol-1 | 348 | 610 | 413 | 436 |
����Լ������Ӧ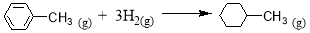 �Ħ�HΪ��384 kJ��mol-1
�Ħ�HΪ��384 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ĸ�����ѧ�ڵ�һ���¿������Ծ��������棩 ���ͣ������
����ѧ����ѡ��2����ѧ�뼼������15�֣�
ľ�Ǵ�(C5H12O5)��������ζ����Ӫ�������ڻ�����ʳƷ��ҽҩ�ȹ�ҵ���й㷺Ӧ�á���������о�еĶ��ǿ�������ľ�Ǵ����乤���������£�

1�����ݹޣ�2��3����Ӧ�ޣ�4����ʽ���˻���5��10��Ũ���ޣ�
6����ɫ����12�����Ļ�(��Һ����װ��)
��֪��ľ����ľ�Ǵ���ת����ϵ��ͼ��
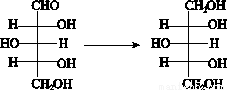
��ش��������⣺
��1��װ��2���������Ҫ������________��
��2��װ��3�м���̼��Ƶ�Ŀ����_____________________________________��
��3��Ϊ��ȥľ�ǽ��е��������ӣ�7��8װ���е������������_____________________��
��4��װ��9��������________��
A����ȴľ�ǽ� B��ˮ��ľ�� C������ľ�� D����ԭľ��
��5��װ��11��������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ������ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���и���������ָ����Һ�У����ܴ����������
������������������ɫ��Һ�У�K+��NH4+��Na+��HSO3-��PO43-��MnO4-
����ʹpH��ֽ������ɫ����Һ�У�K+��Na+��AlO2-��NO3-��S2-��SO32-
��ˮ�����H+Ũ��c(H+)=10-13mol/L����Һ�У�Cl-��CO32-��SO32-��Fe3+��K+
�ܼ���Al�ܷų�H2����Һ�У�Na+��NH4+��K+��SO42-��Cl-��Br-
��ʹʯ�������Һ�У�Fe3+��Na+��K+��NO3-��SO42-��Cl-
��pH=1����Һ�У�Fe2+��Al3+��K+��Na+��NO3-��I-��Cl-��S2-
�ߺ��д���Fe3+����Һ�У�K+��NH4+��Na+��SCN-��I-��Br-
��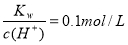 ����Һ�У�Na+��K+��SO42-��SiO32-��NO3-
����Һ�У�Na+��K+��SO42-��SiO32-��NO3-
A���٢ۢܢ� B���٢ۢޢ� C���ڢܢݢ� D���ڢݢߢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�ɶ���2012������Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ȷ��ʾ���з�Ӧ�����ӷ���ʽ��
A������ˮ��Ӧ��Na+2H2O=Na����OH����H2��
B��Kl��Һ�е���ϡ���ᣬ��������4H+ +41-+O2=2I2+2H2O
C��CuCl2��Һ�м��백ˮ��Cu2+ +20H- = Cu(OH)2����
D����NH4HCO3��Һ�мӹ�����NaOH��Һ�����ȣ�NH4����OH�� 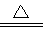 NH3����H2O
NH3����H2O
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com