
【题目】下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
实验 | 金属 | 金属 | c(H2SO4) mol/L | 实验 | 金属消失 | |
1 | 0.10 | 丝 | 0.7 | 20 | 250 | |
2 | 0.10 | 丝 | 1.0 | 20 | 200 | |
3 | 0.10 | 粉末 | 1.0 | 20 | 125 | |
4 | 0.10 | 粉末 | 1.0 | 30 | 50 |
分析上述数据,回答下列问题:
(1)反应的离子方程式:;
(2)①实验1、2可得出的结论是,硫酸浓度越 , 反应速率越慢;
②实验2、3可得出的结论是反应物接触面越大,反应速率越;
③实验3、4可得出的结论是温度越 , 反应速率越快.
(3)①用铁粉和稀硫酸反应制取H2 , 实验过程中绘制出生成H2的体积(V)与时间(t)的关系如图所示. 试分析判断OE段、EF段、FG段、GH段反应速率(分别用v (OE)、v (EF)、v (FG)、v (GH)表示)最快时段是 .
A.v (OE) B.v (EF)
C.v (FG) D.v (GH)
②1min内反应较慢的原因是:;一段时间后反应明显加快的原因是 . 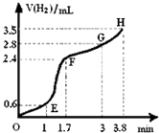
【答案】
(1)Fe+2H+═Fe2++H2↑
(2)稀;快;高
(3)B;温度较低;反应放热,使溶液的温度升高
【解析】解:(1)反应生成硫酸亚铁和氢气,离子反应为Fe+2H+═Fe2++H2↑,所以答案是:Fe+2H+═Fe2++H2↑;(2)①实验1、2中酸的浓度不同,则得出结论为反应物浓度越大,反应速率越快,所以答案是:稀;②实验2、3中接触面积不同,则得出结论为反应物接触面积越大,反应速率越快,所以答案是:快;③实验3、4中温度不同,则得出结论为反应物温度越大,反应速率越快,所以答案是:高.(3)①EF段曲线的斜率较大,说明单位时间生成的二氧化碳最多,则反应速率最大,因此阶段浓度较大,且反应放热,温度较高,反应速率最大,随着反应的进行,浓度逐渐降低,则反应速率逐渐减小,故选B;②1min内反温度较低,反应较慢,一段时间后,反应放热,使溶液的温度升高,反应明显加快,所以答案是:温度较低、反应放热,使溶液的温度升高.


科目:高中化学 来源: 题型:
【题目】对于反应:M+N﹣→P,如果温度每升高10℃,化学反应速率提高到原来的3倍,在10℃时完成反应的10%需要81min,将温度提高到30℃时,完成反应的10%需要的时间为( )
A.9 min
B.27 min
C.13.5 min
D.3 min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂。有研究表明,H2O2溶液的漂白性是HO2—所致。
(1)H2O2溶液显弱酸性,测得0.15 mol·L1 H2O2溶液pH约为6。写出H2O2生成HO2—的电离方程式:。
(2)其他条件相同时,研究不同初始pH条件下H2O2溶液的漂白效果,结果如下: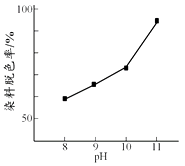
由上图可得到的结论是 , 结合平衡移动原理简述理由:。
(3)实验发现: 若pH >11,则H2O2溶液的漂白效果随pH增大而降低。针对这一现象,继续进行实验,发现溶液中H2O2的分解与pH有关。测定不同初始pH条件下,初始浓度均为0.15 mol·L1 的H2O2溶液发生分解反应,结果如下:
初始pH | pH = 10 | pH = 12 |
1小时后H2O2溶液浓度 | 0.13 mol·L1 | 0.07 mol·L1 |
1小时后pH | 没有明显变化 | 没有明显变化 |
查阅资料:HO2-+H2O2=H2O+O2+OH-。
①结合离子方程式解释1小时后pH没有明显变化的原因:。
②从反应速率的角度分析pH过大,H2O2溶液漂白效果会降低的原因:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下每个选项中的两组物质都能反应,且放出同一种气体产物的是
A.铜与浓硫酸,铜与稀硫酸B.铁与稀硫酸,铁与浓硫酸
C.硫化钠与稀硫酸,硫化钠与稀盐酸D.硫化钠与稀硫酸,亚硫酸钠与稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题: 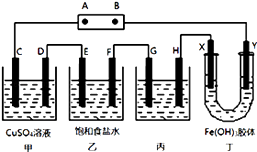
(1)电源A 极的名称是(正极或负极).
(2)甲装置中的C极的电极反应式 .
(3)欲用丙装置给铜镀银,G应该是(填“铜”或“银”),电镀液的主要成分是(填化学式).
(4)装置丁中的现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3性质的出较中,正确的是
A. 等浓度的溶液中滴入稀盐酸,放出气体的快慢Na2CO3<NaHCO3
B. 热稳定性Na2CO3<NaHCO3
C. 常温时水溶性Na2CO3<NaHCO3
D. 可以用澄清石灰水鉴别Na2CO3和NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列实验操作中,错误的是 (填序号,下同)
①用10mL量筒量取6.4mL盐酸;
②切割金属钠时,将残留物放入废物缸中;
③配制FeSO4溶液时一般要加入适量铁屑;
④配制一定物质的量浓度的溶液定容时仰视读数会使所配溶液浓度偏高;
⑤不慎接触过多的氨,应及时吸入新鲜的空气和水蒸气,并用大量水冲洗眼睛;
⑥用带橡皮塞的棕色试剂瓶存放浓HNO3;
⑦稀释浓硫酸时应把水倒入浓硫酸中.
(2)如图为实验室制H2的装置.若液面刚好不与锌粒接触而又无酸液可加入,则可以从长颈漏斗中加入适量试剂是
①食盐水 ②苯 ③四氯化碳④Na2CO3溶液 ⑤硫酸铜溶液 ⑥KNO3溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
实验 | 金属 | 金属 | c(H2SO4) mol/L | 实验 | 金属消失 | |
1 | 0.10 | 丝 | 0.7 | 20 | 250 | |
2 | 0.10 | 丝 | 1.0 | 20 | 200 | |
3 | 0.10 | 粉末 | 1.0 | 20 | 125 | |
4 | 0.10 | 粉末 | 1.0 | 30 | 50 |
分析上述数据,回答下列问题:
(1)反应的离子方程式:;
(2)①实验1、2可得出的结论是,硫酸浓度越 , 反应速率越慢;
②实验2、3可得出的结论是反应物接触面越大,反应速率越;
③实验3、4可得出的结论是温度越 , 反应速率越快.
(3)①用铁粉和稀硫酸反应制取H2 , 实验过程中绘制出生成H2的体积(V)与时间(t)的关系如图所示. 试分析判断OE段、EF段、FG段、GH段反应速率(分别用v (OE)、v (EF)、v (FG)、v (GH)表示)最快时段是 .
A.v (OE) B.v (EF)
C.v (FG) D.v (GH)
②1min内反应较慢的原因是:;一段时间后反应明显加快的原因是 . 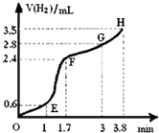
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将pH相同的三种酸性溶液露置于空气中一段时间后,溶液的pH随时间的变化情况如图所示:则a、b、c三种溶液分别可能为( ) 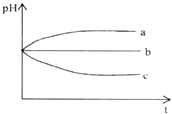
A.H2S溶液、稀H2SO4溶液、H2SO3溶液
B.氯水、稀HNO3溶液、NH4Cl溶液
C.H2SO3溶液、稀HCl溶液、氯水
D.H2S溶液、浓盐酸、H2SO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com