
| A. | 一定有甲烷 | B. | 一定有乙烯 | ||
| C. | 一定没有乙烷 | D. | 可能是甲烷和乙烯的混合物 |
分析 标况下3.36L二氧化碳的物质的量为:n(CO2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,3.6g水的物质的量为:n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,则混合的平均化学式为,C1.5H4,由于是混合物,则肯定含有C原子数小于1.5的烃,即一定含有甲烷,因甲烷中含有4个氢原子,则另一种烃也含有4个氢原子,以此进行解答.
解答 解:标况下3.36L二氧化碳的物质的量为:n(CO2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,3.6g水的物质的量为:n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,
1mol混合气体完全燃烧生成1.5mol二氧化碳、2mol水,则混合的平均化学式为:C1.5H4,
由于两种气态烃的混合物,则一定含有C原子数小于1.5的烃,所以一定含有甲烷,
又由于甲烷中含4个氢原子,则另一种烃也含有4个氢原子,
根据以上分析可知,混合气体中一定含有甲烷,一定没有乙烷,可能为甲烷和乙烯的混合物,但是不一定含有乙烯,故B错误;
故选B.
点评 本题考查了有机物分子式的计算,题目难度中等,注意掌握利用平均分子组成判断烃的组成的方法,明确确定有机物组成时常用方法:平均碳法、平均氢法、平均碳氢分子式法、平均式量法等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 密度 (g•mL-1) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 苯甲酸 | 1.2659 | 122.13 | 249 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
| 苯酚 | 1.07 | 40.6 | 181.9 | 易溶于乙醇、乙醚,65℃以上能与水互溶 |
| 乙醇 | 0.79 | -114.3 | 78.5 | 与水混溶,可混溶于醚、氯仿、甘油等多数有 机溶剂 |
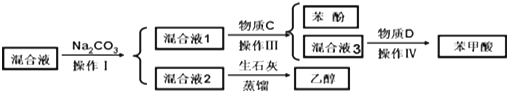
 .
.| 实验步骤 | 现象和结论 |
| ①取少量混合液1于试管,滴加BaCl2, 振荡,静置 | 产生白色沉淀,BaCO3 |
| ②取少量步骤①上层清夜于试管,滴加0.1mol/L盐酸再将产生的气体通入澄清石灰水中 | 澄清石灰水变浑浊 说明混合液1含有HCO3- |
| ③另取少量混合液1于试管,滴加0.1mol/L FeCl3溶液,振荡 | 溶液不显紫色, 说明混合液1不含有酚羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2+2Y2?2XY2 | B. | 3X2+Y2?2X3Y | C. | X2+3Y2?2XY3 | D. | 2X2+2Y2?2X2Y |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解时在阳极得到金属钠 | |
| B. | 在阴极附近的溶液中滴入酚酞溶液,溶液呈红色 | |
| C. | 在阴极附近有黄绿色的气体产生,并能使湿润淀粉碘化钾试纸变蓝 | |
| D. | 电解一段时间后,将电解液全部转移到烧杯中,充分搅拌后溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | COCl2分子的结构式: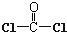 | B. | 苯分子的比例模型: | ||
| C. | NaOH的电子式: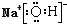 | D. | 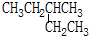 的名称:2-乙基丁烷 的名称:2-乙基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com