
【题目】实验室需要制备22.4L(标准状况)H2,现用质量分数为90.0%的锌粒与足量的稀盐酸反应(假设杂质不与稀盐酸反应),问:(要求写出计算过程)
(1)至少需要质量分数为90.0%的锌粒多少克?____
(2)生成的氯化锌的物质的量是多少?______
科目:高中化学 来源: 题型:
【题目】下列每组中各有三对物质,它们都能用分液漏斗分离的是 ( )
A. 乙酸乙酯和水,酒精和水,乙酸和水
B. 溴苯和水,甲苯和苯,醋酸和水
C. 汽油和水,乙酸和水,乙酸和乙醇
D. 乙酸乙酯和水,甲苯和水,苯和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.标准状况下,1mol任何物质的体积约为22.4L
B.O2的摩尔质量是32g/mol,所以2molO2的质量是64g
C.氯化氢气体的摩尔质量与NA 个氯化氢分子的质量在数值上相等
D.1mol氢气和氧气的混合气体中含有的分子数为6.02×1023 个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示。请回答下列问题:

(1)写出A中反应的化学方程式 ________。
(2)B中选用的试剂是_______,其作用是_______;C 中选用的试剂是________,其作用是_______。
(3)装置E的目的是________,写出 E 中发生反应的化学方程式:_________。
(4)但实验发现D中得到的无水CuCl2总是偏蓝色,请你提出改进方案:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种重要的过渡金属元素,工业上由钼精矿(主要成分是MoS2)制备单质钼和钼酸钠晶体(Na2MoO42H2O)的流程如下:

(1) Na2MoO42H2O中Mo元素的化合价为____;钼精矿焙烧的主要反应中,氧化剂和还原剂物质的量之比为________。
(2)流程中由Na2MoO4溶液获得晶体的操作是_________、过滤、洗涤、干燥。加入Na2CO3溶浸时发生的主要反应的离子方程式为______________。
(3)操作1中,所得Na2MoO4溶液中含SO42+杂质,其中c(MoO42+)0.80mol/L,c(SO42-)=0.04mol/L在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。当 BaMoO4开始沉淀时,SO42-的去除率是______。[Ksp(BaSO4)=1.1×10-10、Ksp( BaMoO4)=4.0×10-8,溶液体积变化可忽略]
(4)工业上钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,该法的优点是_____。
(5)高纯Mo可用于制造电池级MoS2,Li-MoS2电池是一种性能优异的二次电池,其电池反应为:xLi+nMoS2![]() Lix(MoS2)n,该电池放电时正极反应为______________;充电时Li+移动方向为________(填“由阳极移向阴极”或“由阴极移向阳极”)。
Lix(MoS2)n,该电池放电时正极反应为______________;充电时Li+移动方向为________(填“由阳极移向阴极”或“由阴极移向阳极”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①标准状况下5.6 L氢气、②33 g二氧化碳、③0.5 mol氯气、④2.408×1023氦气(He)四种物质,下列排序错误的是
A.四种物质所含分子数目从大到小的顺序是:②>③>④>①
B.四种物质质量从大到小的顺序是:③>②>④>①
C.四种气体在标准状况下的体积从大到小的顺序是:②>③>④>①
D.四种物质所含原子数目从大到小的顺序是:②>③>④>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学需帮助水质检测站配制480mL0.1mol·L-1Na2CO3溶液以备使用。
(1)该同学应选择___mL的容量瓶,容量瓶使用前要____。
(2)其操作步骤如图甲所示,则图乙操作应在图甲中的___(填选项字母)之间。
A.②与③ B.①与② C.④与⑤

(3)该同学应称取Na2CO3·10H2O固体_____g。
该操作有如下几步:
A.将游码拨至相应处; B.将游码拨至“0”处; C.在天平两边的托盘上各放一张干净的等质量的滤纸,调节天平两边的螺母使天平平衡; D.取走药品,将砝码放回砝码盒内; E.往左盘内逐步添加晶体至天平平衡; F.在右盘上放置砝码。
其正确的操作顺序是(填字母):B―→(____)―→F―→A―→(____)―→(____)―→B。
(4)关于配制该溶液的说法,分析正确的是____(填序号)
①整个配制过程中,容量瓶不振荡,会使溶液浓度偏高;
②托盘天平只能粗略地称量物质的质量,量筒只能粗略地量取液体的体积,严格地说,它们都不能与容量瓶——精确仪器配套使用;
③引流时,玻璃棒不能靠在瓶口上;
④称量的固体(或量取的液体)可直接放入容量瓶中溶解(或稀释);
⑤定容摇匀后,若液面低于刻度线,可再次加水补充;
⑥选用的容量瓶内有少量蒸馏水,会使配制的溶液浓度偏低。
查看答案和解析>>
科目:高中化学 来源: 题型:
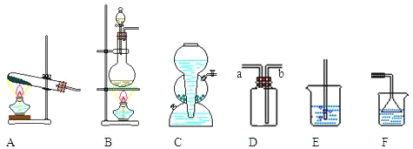
【题目】请回答与 HCl 的实验室制法和性质探究的相关问题:
(1)实验室用食盐晶体与浓硫酸在微热条件下反应制取氯化氢气体,反应的化学方程式为___________。
(2)氯化氢气体的发生装置应该选择图中的_______(填装置的编号,下同)。实验室常用装置D来收集氯化氢,则收集氯化氢时,气体从_____管(填a或b)进入。用水吸收多余的氯化氢气体时,可以选择装置_____。
(3)某同学欲证明盐酸与氯化氢气体性质不同,他向A、B、C 三支洁净试管里各放一片干燥的蓝色石蕊试纸,然后向A试管里加入盐酸,试纸显_____色;往B试管中通入干燥的氯化氢气体,试纸显_____色。 这时他认为由此还不能得出满意的结论,于是向C试管中加入化学式为_______的物质,目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,AgX(X=Cl、Br)的溶度积与c(Ag+)和c(X-)的相互关系如下图所示,其中A线表示AgCl,B线表示AgBr,已知p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-)。下列说法正确的是( )

A. c点可表示AgCl的不饱和溶液
B. b点的AgCl溶液加入AgNO3晶体可以变成a点
C. t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K=10-4
AgBr(s)+Cl-(aq)平衡常数K=10-4
D. t℃时,取a点的AgCl溶液和b点AgBr溶液等体积混合,会析出AgBr沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com