
【题目】实验室常用![]() 与浓盐酸反应制备
与浓盐酸反应制备![]() 。
。
(1)制备反应会因盐酸浓度下降面停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量![]() 溶液反应,称量生成的
溶液反应,称量生成的![]() 质量。
质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与己知量![]() (过量)反应,称量剩余的
(过量)反应,称量剩余的![]() 质量。
质量。
丁方案:与足量![]() 反应,测量生成的
反应,测量生成的![]() 体积。
体积。
继而进行下列判断和实验:
①判定甲方案不可行。现由是_________。
②进行乙方案实验;准确量取残余清液稀释一定倍数后作为试样。
a.量取试样![]() ,用
,用![]() 标准溶液滴定,选择的指示剂是____,消耗
标准溶液滴定,选择的指示剂是____,消耗![]() ,该次滴定测得试样中盐酸浓度为_______
,该次滴定测得试样中盐酸浓度为_______![]()
b._________,获得实验结果。
③判断两方案的实验结果________(填“偏大”、“偏小”或“准确”).
[已知:![]() 、
、![]() ]
]
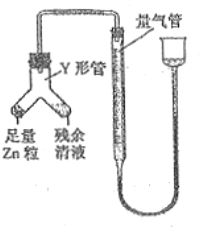
④进行丁方案实验:装置如图所示(夹持器具已略去)。
a.使Y形管中的残余清液与锌粒反应的正确操作是将_______转移到____中。
b.反应完毕,每间隔1分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是__________(排除仪器和实验操作的影响因素),至体积不变时,量气管的左侧液面高于右侧液面,此时读数测得的体积__________(填“偏大”、“偏小”或“准确”)
(2)若没有酒精灯,也可以采用![]() 与浓盐酸反应制取适量氯气的如下简易装置。
与浓盐酸反应制取适量氯气的如下简易装置。
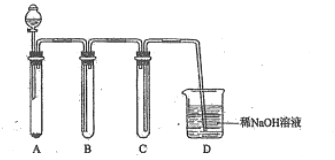
装置B、C、D的作用分别是:
B___________C______________D______________
【答案】残余液中的![]() 也会与
也会与![]() 反应形成沉淀 甲基橙 0.1100 重复上述滴定操作2-3次 偏小 锌粒 残余清液 装置内气体尚未冷却至室温 偏大 收集氯气 防倒吸 吸收尾气
反应形成沉淀 甲基橙 0.1100 重复上述滴定操作2-3次 偏小 锌粒 残余清液 装置内气体尚未冷却至室温 偏大 收集氯气 防倒吸 吸收尾气
【解析】
(1)①甲同学的方案:二氧化锰与浓盐酸反应生成氯化锰,也会与硝酸银反应,故反应不可行;
②用强碱滴定强酸,可选甲基橙作指示剂;依据滴定实验过程中的化学反应定量计算;重复滴定操作2-3次,求平均值;
③与已知量CaCO3(过量)反应,称量剩余的CaCO3质量,由于部分碳酸钙与转化成碳酸锰沉淀,称量剩余的固体质量会偏大;
④依据锌粒与稀盐酸反应生成氢气进行分析解答;使Zn粒进入残余清液中让其发生反应.这样残余清液就可以充分反应.
反应完毕时,相同时间内则气体体积减少,又排除了其它影响因素,只能从气体本身角度思考,联想到该反应是放热的,就可能想到气体未冷却了。
气体的体积与压强呈反比。
(2)A制取氯气 B用向上排空法收集氯气,C防倒吸 D 吸收尾气,防止污染空气。
(1)①甲同学的方案:二氧化锰与浓盐酸反应生成氯化锰,也会与硝酸银反应,故不能用来测定残余液中盐酸的质量,反应不可行;
②用强碱滴定强酸,可选甲基橙作指示剂;量取试样20.00mL,用0.1000mol·L-1 NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度,由cHClVHCl=cNaOHVNaOH可得出盐酸的浓度为0.1100mol·L-1;
③根据Ksp(CaCO3)=2.8×10-9,Ksp(MnCO3)=2.3×10-11知碳酸锰的Ksp比碳酸钙小,由于部分碳酸钙与转化成碳酸锰沉淀,称量剩余的固体质量会偏大,这样一来反应的固体减少,实验结果偏小,
④a.丁同学的方案:使Y形管中的残余清液与锌粒反应的正确操作是:将锌转移到残留溶液中;
b.反应完毕后,每间隔1分钟读取气体体积.气体体积逐渐减小,气体体积逐渐减小的原因是气体未冷却到室温,当温度冷却到室温后,气体体积不再改变;
量气管的左侧液面高于右侧液面,左侧气体的压强偏小,此时读数测得的体积偏大;
(2)根据装置图可知各装置的作用分别是A制取氯气,B用向上排空法收集氯气,C防倒吸, D 吸收尾气,防止污染空气。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】利用SCR技术可有效降低柴油发动机NOx排放。SCR工作原理为尿素[CO(NH2)2]水溶液热分解为NH3和CO2,再利用NH3转化NOx,装置如图所示:
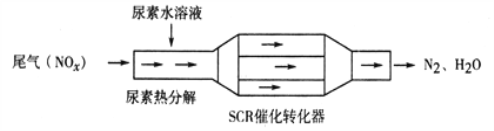
下列说法不正确的是( )
A. 尿素水溶液热分解反应不属于氧化还原反应
B. 转化器工作过程中,当转移0.6mol电子时,会消耗4.48L NH3
C. 该装置转化NO时,还原剂与氧化剂物质的量之比为2:3
D. 转化NO2过程的化学方程式为:8NH3+6NO2![]() 2N2+12H2O
2N2+12H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素W、X、Y、Z的原子序数依次增加,且均小于20。W、X、Y、Z的族序数之和为12;X与Y的电子层数相同;向过量的ZWY溶液中滴入少量胆矾溶液,观察到既有黑色沉淀生成又有臭鸡蛋气味的气体放出。下列说法正确的是( )
A. ZWY是离子化合物,既可以与酸反应又可以与碱反应
B. 晶体X熔点高、硬度大,可用于制造光导纤维
C. 原子半径由小到大的顺序为:![]()
D. 热稳定性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中美学者携手发现了全硼富勒烯团簇一B40,B40团簇的结构,酷似中国的红灯笼(如图)该材料可用于组装分子器件,在储氢储锂、半导体、超导、绿色催化等领域具有重要应用前景,下列有关说法正确的是
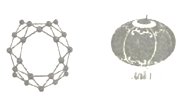
A.与石墨烯的结构相同,二者互为同素异形体
B.44.0g该物质含有2.408×1024个原子
C.B40中既含极性键,又含有非极性键
D.全硼富勒烯团簇是一种新型的高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 N2(g)与H2(g)在铁催化剂表面经历如下过程生成NH3(g),则下列说法正确的是

A.Ⅰ中破坏的均为极性键
B.Ⅳ中NH2与H2生成NH3
C.Ⅱ、Ⅲ、Ⅳ均为放热过程
D.N2(g)+3H2(g)![]() 2NH3(g)1mol氮气完全反应放热44kJ
2NH3(g)1mol氮气完全反应放热44kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.MnO2与浓盐酸反应制Cl2:MnO2+4HCl![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B.碳酸钙与醋酸溶液反应:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
C.200mL2mol/L的FeBr2溶液中通入11.2L标准状况下的氯气:
4Fe2+ + 6Br-+ 5Cl2 == 4Fe3+ + 3Br2 + 10Cl-
D.Na2S的水解:S2- + 2H2O ![]() H2S + 2OH-
H2S + 2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用下列装置,进行与氯气相关的实验。
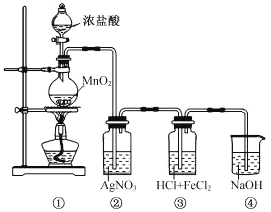
(1)装置④中NaOH溶液的作用是___________。
(2)实验结束后,取装置③中的溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到FeCl3·6H2O晶体。在蒸发浓缩操作中,不需要的仪器是___________。
A.蒸发皿 B.漏斗 C.玻璃棒 D.酒精灯
(3)装置②中出现白色沉淀,据此现象能否推测装置①中生成Cl2___________________,请说明理由_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CHSO4固体为电解质传递OH一,其基本结构见下图,电池总反应可表示为:2H2+O2===2H2O,下列有关说法不正确的是

A. 电子通过外电路从a极流向b极
B. b电极为正极
C. a极上的电极反应式为:H2-2e-=== 2 H+
D. 该装置能将化学能转变为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钾的冶炼可采用如下方法:2KF+CaC2![]() CaF2+2K↑+2C,下列有关说法合理的是( )
CaF2+2K↑+2C,下列有关说法合理的是( )
A.该反应的氧化剂是KF,氧化产物是K
B.该反应能说明C的还原性大于K
C.电解KF溶液不可能制备金属钾
D.CaC2、CaF2均为离子化合物,且阴、阳离子个数比均为2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com