
【题目】填空:
(1)明矾【KAl(SO4)2·12H2O】净水原理(用离子方程式表示):____________________;常温下,小苏打水溶液呈 性(填“酸”“碱” 或“中”)。 把上述两溶液混合,反应的离子方程式是 。
(2)实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于 中,然后再用
稀释到所需的浓度。
(3)用纯碱溶液清洗油污时,加热可以增强其去污能力,请简述原因(书写离子方程式,并用文字加以简单说明)
【答案】(1)Al3++3H2O![]() Al(OH)3+3H+ 碱性 Al3++3HCO3-=Al(OH)3↓+3CO2↑
Al(OH)3+3H+ 碱性 Al3++3HCO3-=Al(OH)3↓+3CO2↑
(2)稀硝酸 蒸馏水
(3)CO32-+H2O![]() HCO3-+OH- ,CO32-的水解使溶液显碱性,水解是吸热反应,升温促进水解,溶液碱性增强,去污效果好
HCO3-+OH- ,CO32-的水解使溶液显碱性,水解是吸热反应,升温促进水解,溶液碱性增强,去污效果好
【解析】
试题分析:(1)明矾电离出的铝离子水解,生成氢氧化铝胶体,胶体具有吸附性而净水,离子方程式为Al3++3H2O![]() Al(OH)3+3H+;碳酸氢根的水解程度大于电离程度,因此小苏打溶液显碱性;碳酸氢根和铝离子水解相互促进,生成氢氧化铝和CO2,反应的离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑;
Al(OH)3+3H+;碳酸氢根的水解程度大于电离程度,因此小苏打溶液显碱性;碳酸氢根和铝离子水解相互促进,生成氢氧化铝和CO2,反应的离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(2)为了防止硝酸银水解,实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于稀硝酸中,然后再用蒸馏水稀释到所需的浓度。
(3)碳酸根水解溶液显碱性,水解吸热,因此升高温度可以增强其去污能力,离子方程式为CO32-+H2O![]() HCO3-+OH-。
HCO3-+OH-。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等杂质)制取金属锌的工艺流程如下:回答下列问题:

(1)ZnFe2O4是一种性能优良的软磁材料,也是一种催化剂,能催化烯类有机物氧化脱氢等反应。
①ZnFe2O4中Fe的化合价是__________,从物质分类角度说,ZnFe2O4属于_________ (填“酸”、“碱”或“盐”)。
②工业上利用反应ZnFe2(C2O4)3·6H2O![]() ZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4。该反应中氧化产物是_______ (填化学式),每生成1mol ZnFe2O4,转移电子的物质的量是_____。
ZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4。该反应中氧化产物是_______ (填化学式),每生成1mol ZnFe2O4,转移电子的物质的量是_____。
(2)酸浸时要将锌焙砂粉碎,其目的是提高酸浸效率。为达到这一目的,还可采用的措施是______________________(任答一条);已知ZnFe2O4能溶于酸,则酸浸后溶液中存在的金属离子有__________________。
(3)净化I中H2O2参与反应的离子方程式为_______________________;试剂X的作用是_________________________。
(4)钢铁镀锌是钢铁防护的一种有效方法。按图甲装置进行模拟铁上镀锌的实验,实验结果如图乙所示。乙中横坐标x表示电路中通过电子的物质的量,纵坐标y表示反应物或生成物的物质的量。

①C电极的电极反应式为___________________________。
②E可以表示的量是__________________________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活密切相关,下列说法正确的是( )
A. 有机玻璃受热软化,易于加工成型,是一种硅酸盐材料
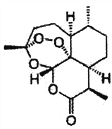
B. 世界卫生组织认为青蒿素(结构如图所示)联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命
C. 纯银器在空气中久置变黑是因为发生了电化学腐蚀
D. 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 只用水就可以鉴别四氯化碳、苯和乙醇
B. C2H4、C3H6、C6H6分子中,所有原子处于同一平面上
C. 光照条件下,氯气与乙烷发生化学反应,生成的产物有6种
D. 有机物![]() 与氯气发生取代反应,生成的一氯代物有5种
与氯气发生取代反应,生成的一氯代物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 用右图所示方法可保护钢闸门不被腐蚀
B. SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0
C. 常温下,NH4Cl溶液加水稀释,![]() 增大
增大
D. C(s)+H2O(g)![]() CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动
CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境和资源是人类面临的两大课题,下列说法正确的是( )
A. 燃煤中加入生石灰既可减少酸雨的产生,又可减少温室气体的排放
B. 石油分馏所得的汽油、煤油等产品均属于化合物
C. 海水淡化后所得的盐卤可提取溴、镁等多种重要元素
D. 沼气的主要成分为CH4,属于不可再生资源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)溶液中,c(H+)=10-x mol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示。
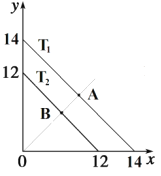
①若从A点到B点,可采取的措施为_________。
②T2 ℃时,将pH=0的NaHSO4溶液逐滴滴加到pH=2 的醋酸溶液中,则水电离出的c(OH-)将______(填“增大”、“减小”、“不变”)。
③已知:T1 ℃时, 醋酸的电离常数为 1.8×10-5,则 T1 ℃时, 在 0.5 mol·L-1的醋酸溶液中由醋酸电离出的 c(H+)约是水电离出的 c(H+)的__________ 倍。
④T2 ℃时,将某溶液(此溶液满足 lg [c(H+)/c(OH-)]=10)滴入含 Na+、 HS-、 SO42-、 K+的溶液中,发生反应的离子方程式为___________。
(2)体积均为1 mL pH=2的一元酸HA和HB,加水稀释过程中pH与溶液体积关系如图所示:
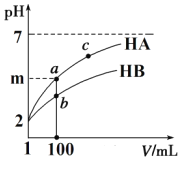
①m的取值为______________。
②a点酸的浓度____________b点酸的浓度(填 “>”、“<”、“=”)。
③若 m<4,常温下a点到c点的过程中,下列表达式的数据变大的是_____________。
A.c(A-) B. n(H+)· n(OH-) C. c(H+)/c(A-) D. c(A-)/[c(HA)· c(OH-)]
(3)已知:25 ℃时,HCN、H2CO3 的电离平衡常数分别为K=4.9×10-10,K1=4.3×10-7、K2=5.6×10-11,向NaCN溶液中通入少量CO2,所发生反应的离子方程式为:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com