
分析 气态烃的密度是相同状况下氢气密度的28倍,则相对分子质量为56,1mol该烃在空气中完全燃烧生成水72g,可知n(H2O)=$\frac{72g}{18g/mol}$=4mol,则1mol烃含有8molH,结合相对分子质量可确定C原子数,进而确定分子式和结构简式.
解答 解:(1)气态烃的密度是相同状况下氢气密度的28倍,则相对分子质量为28×2=56,
答:该烃的相对分子质量为56;
(2)1mol该烃在空气中完全燃烧生成水72g,可知n(H2O)=$\frac{72g}{18g/mol}$=4mol,则1mol烃含有8molH,则N(C)=$\frac{56-8}{12}$=4,则分子式为C4H8,
答:该烃的分子式为C4H8;
(3)分子式为C4H8,如为烯烃,则对应的结构简式有CH2=CHCH2CH3、CH2=C(CH3)CH3、CH3CH=CHCH3,
答:属于烯烃的同分异构体的结构简式有CH2=CHCH2CH3、CH2=C(CH3)CH3、CH3CH=CHCH3.
点评 本题考查了有机物分子式、结构简式的确定,侧重考查学生的分析能力和计算能力,题目难度中等,注意掌握质量守恒定律在确定有机物分子式中的应用方法,明确同分异构体的概念及书写原则.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
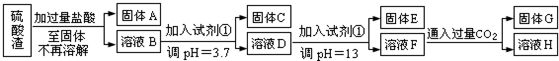

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
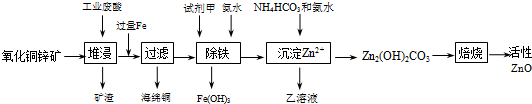
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
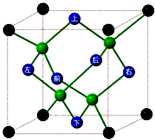 A、B、C、D、E、F六种元素的原子序数依次递增.已知:
A、B、C、D、E、F六种元素的原子序数依次递增.已知: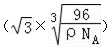 cm,则晶体的密度为$\frac{ρ}{64}$g/cm3.
cm,则晶体的密度为$\frac{ρ}{64}$g/cm3.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4 NH3•H2O═[Al(OH)4]-+4NH4+ | |
| B. | 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O | |
| C. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com