
| A. | 在已知元素中具有最大的原子半径 | B. | 其单质的熔点比金属钠的熔点高 | ||
| C. | 氧化物对应的水化物是极强的碱 | D. | 金属钫与氧气或水反应非常剧烈 |
分析 Fr属于碱金属元素,位于第七周期,根据同主族元素性质的相似性和递变性解答该题.
解答 解:A.同主族元素从上到下原子半径逐渐增大,同周期从左到右原子半径逐渐减小,则则Fr在周期表中具有最大的原子半径,故A正确;
B.碱金属元素从上到下单质的熔点逐渐降低,故Fr单质的熔点比金属钠的熔点低,故B错误;
C.Fr在碱金属中元素的金属性最强,对应的氧化物的水化物的碱性极强,故C正确;
D.在碱金属元素中只有Li生成Li2O,其它元素对应的单质能生成氧化物、过氧化物、超氧化物,而跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸,故D正确;
故选B.
点评 本题考查同主族元素的性质的递变规律,注意同主族元素既具有性质的相似性,又具有递变性,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入2mL0.1mol•L-1盐酸 | B. | 加入2mL0.1mol•L-1氢氧化钡溶液 | ||
| C. | 加入2mL0.1mol•L-1硫酸铜溶液 | D. | 加入2mL0.1mol•L-1氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气的主要成分为CH4 | |
| B. | 乙烯与溴的四氯化碳溶液可发生加成反应 | |
| C. | CH4的二氯代物只有一种,此事实可说明CH4为正四面体结构 | |
| D. | 除去甲烷气体中的乙烯可以将混合气体通过盛有足量酸性高锰酸钾溶液的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>R>Y | |
| B. | 气态氢化物稳定性:HmW>HnR | |
| C. | Y、Z、R三种元素组成的化合物水溶液一定显中性 | |
| D. | X2W6分子中各原子均满足8电子结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
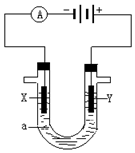 人们习惯上把电解饱和食盐水的工业叫做氯碱工业.
人们习惯上把电解饱和食盐水的工业叫做氯碱工业.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com